https://www.cphi.cn 2021-06-02 10:57 来源:CPhI制药在线 作者:老陈
背景
2021年5月31日,国家药品监督管理局在其官网通过“国家药监局关于印发《药品检查管理办法(试行)》的通知(国药监药管〔2021〕31号)”发布了《药品检查管理办法(试行)》,并且自发布之日(即2021年5月31日)起实施。笔者对《药品检查管理办法(试行)》简单梳理,整理了一份药品生产企业接待官方检查的清单,以飨读者。
正文
药品生产企业要接待好官方检查,就必须明白官方检查的相关要求和内容。本文将从药品检查的基本知识、接受检查过程和检查后续工作三方面展开说明。
一、药品检查的基本知识
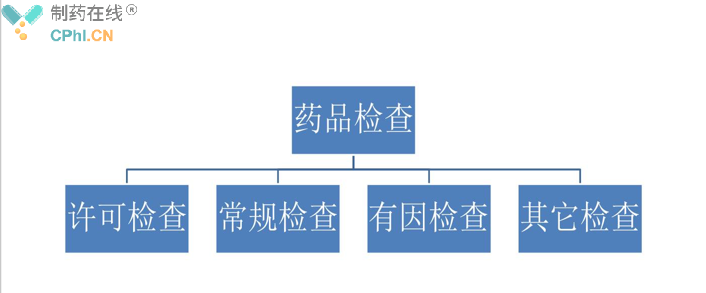
(一)、药品检查的分类
药品检查分为许可检查、常规检查、有因检查、其他检查。
(二)检查发现
1、涉嫌违法
如果涉嫌违法行为可能存在药品质量安全风险的,负责该药品生产企业监管工作的药品监督管理部门应责令该药品生产企业采取相应风险控制措施。
如果发现药品生产企业涉嫌犯罪的,负责该药品生产企业监管工作的药品监督管理部门应按照相关规定,依法及时移送或通报公安机关。
2、拒绝和逃避监督检查
如果有证据证明药品生产企业可能存在安全隐患的,药品监督管理部门根据监督检查情况,应当采取告诫、约谈、限期整改以及暂停生产、销售、使用、进口等措施,并及时公布检查处理结果。
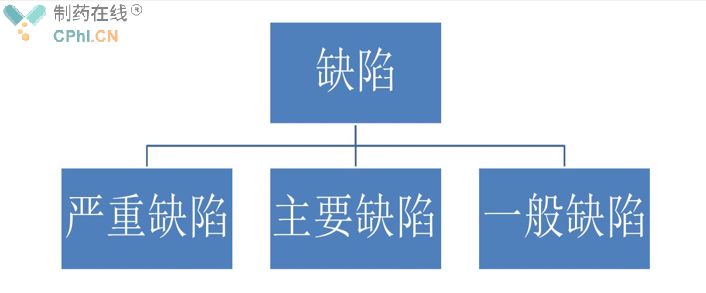
3、缺陷
缺陷分为严重缺陷、主要缺陷和一般缺陷,其风险等级依次降低。
对药品生产企业的检查,依据《药品生产现场检查风险评定指导原则》确定缺陷的风险等级。药品生产企业重复出现前次检查发现缺陷的,风险等级可以升级。
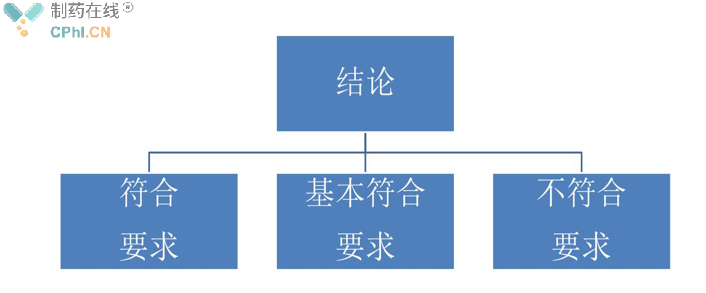
(三)、现场结论
现场检查结论和综合评定结论分为符合要求、基本符合要求、不符合要求。
二、迎接检查过程
(一)、参加首次会议
官方开展药品现场检查开始时,会召开首次会议。如果官方召开首次会议,药品生产企业相关人员应积极参加检查组召开的首次会议。首次会议上应和检查组确认检查的目的、范围和内容。
(二)、接受检查
药品生产企业在检查过程中应当及时提供检查所需的相关资料。同时,药品生产企业相关人员在回答检查人员的问题,一定要把问题问清楚再回答,以免产生误解。如果产生误解,及时请相关人员解释清楚。
检查过程中,如果检查组需要对药品生产企业的产品、中间体和原辅包抽样、送检时,药品生产企业要配合检查组抽样和送检。
(三)参加末次会议
现场检查结束后,检查组召开末次会议时,药品生产企业相关人员应积极参加。
如果检查结论是符合要求,这是检查组人员和药品生产企业最乐意的事情。药品生产企业接待人员要签字和加盖公司公章进行确认。
如果检查结论是基本符合要求或不符合要求,药品生产企业检查结论有异议的,可以陈述申辩。
如果涉嫌违法或者拒绝和逃避监督检查,药品生产企业应积极主动配合检查组人员工作。
三、检查后的后续工作
(一)、涉嫌违法
涉嫌违法行为可能存在药品质量安全风险的,负责被检查单位监管工作的药品监督管理部门应当在接收证据材料后,进行风险评估,作出风险控制决定,责令被检查单位采取相应风险控制措施。
案件查办过程中发现药品生产企业涉嫌犯罪的,药品监督管理部门应当按照相关规定,依法及时移送或通报公安机关。
(二)拒绝和逃避监督检查
对有证据证明可能存在安全隐患的,药品监督管理部门根据监督检查情况,应当采取告诫、约谈、限期整改以及暂停生产、销售、使用、进口等措施,并及时公布检查处理结果。
(三)缺陷
如果检查发现的缺陷是质量安全风险轻微的缺陷,可即时整改的即时整改;一般情况现场检查结束后,药品生产企业应当在20个工作日内针对缺陷项目进行整改。无法按期完成整改的,应当制定切实可行的整改计划,将整改计划及时提交给检查组和派出检查单位,请其确认;一旦整改完成,药品生产企业要及时将整改报告提交给检查组和派出检查单位。必要时,派出检查单位可以对被检查单位整改落实情况进行现场检查。
总结
首先,药品生产企业要做好接待官方检查的工作,就要按照《中华人民共和国药品管理法》《药品生产监督管理办法》等有关法律法规规章,合法经营。如果药品生产企业合法经营,就不会出现涉嫌犯罪的情况。
其次,药品生产企业在接受检查时,积极配合检查组工作,就不会有拒绝和逃避监督检查的结果。一般情况下,药品生产企业都不会拒绝和逃避监督检查的。
最后,药品生产企业在接受检查时,对检查组发现的缺陷很诚恳接受,并积极进行整改。不但会持续改进药品生产企业管理体系,还能给药品监督管理部门和检查组留下良好的印象,进而获得降低检查频率的结果。
总之,药品生产企业要接待好药品检查(官方检查),首先要通过培训,让员工熟悉相关的法律法规的要求,并按照法律法规要求进行生产,做到合法生产和合法经营。其次,通过培训让领导层明白,如果涉嫌违法的后果;让管理层明白,如果拒绝和逃避监督检查的后果。最后,通过培训让全员明白,检查发现缺陷的后果。同时,让公司领导层和管理层明白,对已经发现的缺陷积极整改的意义。
作者简介:老陈,质量管理专家,从事食品与制药行业质量管理和质量控制相关工作近二十年,历任QA主管、质量部长、质量经理和生产厂长等职。在国内著名的跨国明胶企业负责质量和食品安全管理体系管理工作。
版权所有,未经允许,不得转载。
投稿合作联系方式: Kelly.Xiao@imsinoexpo.com 021-33392297
地址:上海市徐汇区虹桥路355号城开国际大厦7-8楼 200030