https://www.cphi.cn 2019-12-31 10:20 来源:CPhI制药在线 作者:1°C
2019年即将结束,2019年美国获批药物数量定格在50款,创新药获批数量位列近十年TOP2。
FDA历年获批上市的药物数量
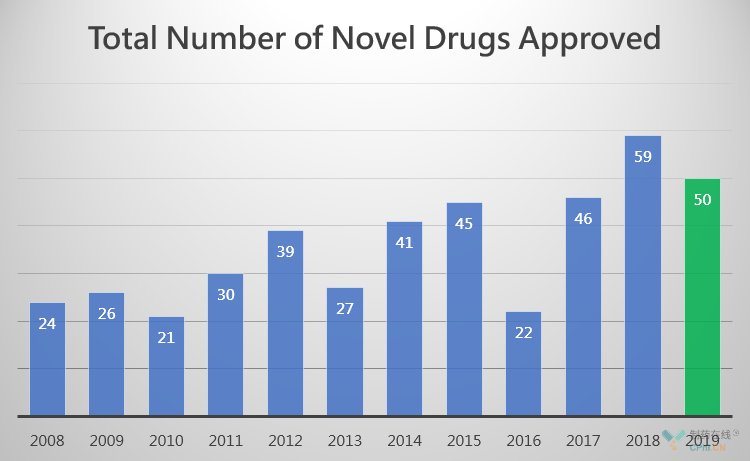
文章《2019 FDA:批准42款新药,9款生物类似药,3款在路上》已经对个别first-in-class创新药、个别治疗领域内的重要创新药做了介绍,毫无疑问,FDA仍是全球医药创新的高地,引领全球创新,药物给癌症治疗、罕见病治疗不断带来具有里程碑意义的突破性疗法。细胞疗法、基因疗法、核酸药物等等重磅技术创新药率先在美国获批可及。
本文希望立足中国和美国创新药物可及性的差异,介绍美国2019年获批的从药物的靶点、治疗领域和技术3个方面分析2019年美国获批创新药。
一.2019美国获批上市代表性药物:罕见病,重磅创新疗法,RNAi中国本土开发多为空白
笔者并没有逐个分析FDA获批上市的药物,从疾病、技术、药物等3个层面去剖析美国2019年获批上市的创新药,希望从一个侧面对比分析中国与美国创新药开发。
2019美国获批上市的代表性药物
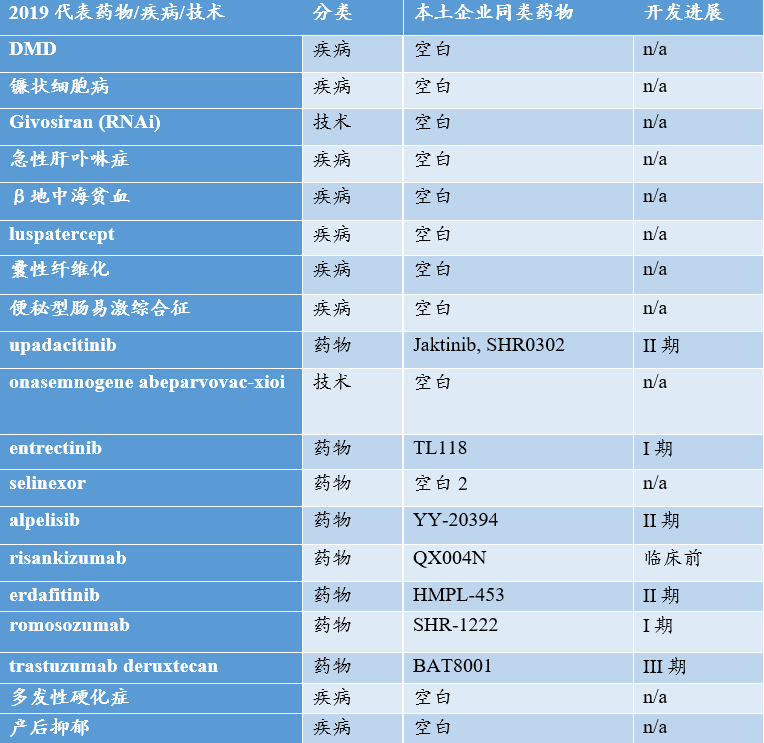
本土企业同类药品不包括拥有中国开发的产品。1. 复星医药拥有selinexor中国开发权;2. 德琪拥有中国开发权
通过对2019美国获批上市药物的分析,我们不难看出,中国企业在多个疾病,尤其是罕见病,多个技术领域,多个靶点的创新仍显不足,与全球仍有差距,原因是多方面的,具体的:
1. 治疗领域看,罕见病 (DMD, 镰状细胞病, 急性肝卟啉症, β地中海贫血, 多发性硬化症等) 开发为空白,重磅创新药物可及性差。个别疾病 (如多发性硬化症) 国内已有进口药物获批上市,但是药物的真正可及仍很难做到,疾病支付压力大;
2. 技术领域看,基因疗法基本是空白,今又生并无法与onasemnogene abeparvovac类药物相提并论;
3. 技术领域看, 全球已有2款RNAi药物获批上市,但是国内RNAi药物仍为空白,仍未有一家国内企业涉足RNAi;
4. 个别靶点看,若仅限定2019年获批上市的药物,国内企业同类药物开发的进度仍大幅落后,follow速度仍有很大的提升空间!
5. 自身免疫的IL-23靶点,全球首款 Tremfya (guselkumab) 已于2017年获批,中国同类药物仍处于临床前开发阶段;自身免疫的JAK靶点,全球首款Xeljanz (托法替尼) 已于2012年获批上市,中国同类产品恒瑞医药SHR0302处于2期临床阶段;
6. 乳腺癌经典靶点HER2,全球该靶点的创新药开发一直在突破中,例如罗氏先后推出曲妥珠单抗、帕妥珠单抗、恩美曲妥珠单抗,曲妥珠单抗和帕妥珠单抗复方;阿斯利康新一代抗体偶联药物trastuzumab deruxtecan;MacroGenics 曲妥珠单抗优化版margetuximab;ZW25/ZW49等。但是,20多年来,中国并无任何一个自主开发的HER2大分子药物获批上市,在此领域鲜有建树。
2019年,FDA批准的50款药物中,givosiran 和 trastuzumab deruxtecan是2款极具典型意义的药物,一个开创了一个新的技术时代,一个代表着经典靶点的重磅突破!创新无处不在。
RNAi药物:递送技术
更具体的,从RNAi药物开发看,2019年GIVLAARI (givosiran) 的美国获批上市揭开了一个新的时代,大神级玩家Alnylam开发的首个采用ESC-GalNAc递送技术的RNAi药物正式获批,ESC-GalNAc靶向修饰技术时代,RNA技术迈入新的发展阶段,正如Alnylam公告中所讲:
"GIVLAARI Becomes Second RNAi Therapeutic from Alnylam Approved by FDA in Last 16 Months and First-Ever Approval for a GalNAc-Conjugate RNA Therapeutic, a Landmark in Advancement of Precision Genetic Medicines"
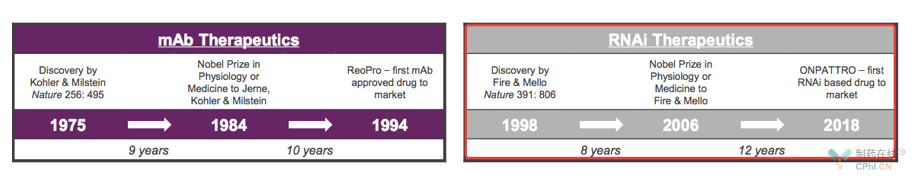
数据来源:Alnylam
详见《GIVLAARI (givosiran)获批揭开GalNAc技术时代 谈RNAi疗法的大神级玩家Alnylam》
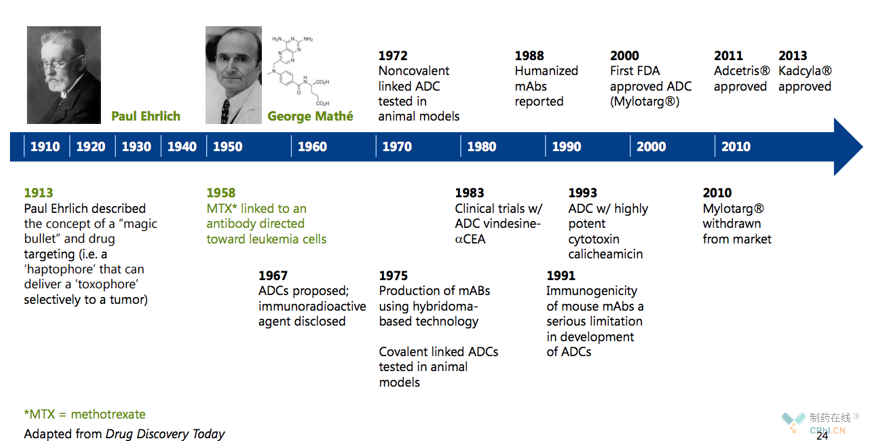
圣诞收官之作Enhertu:HER2给乳腺癌带来的突破从未停歇
第一三共抗体偶联药物造诣颇深,trastuzumab deruxtecan在很早便引起普遍关注,笔者前文《阿斯利康69亿美元购入肿瘤资产:Trastuzumab Deruxtecan到底有多么优秀》,详细介绍了Trastuzumab Deruxtecan的早期临床数据、分子优势和市场潜力,药物代表着抗体偶联药物进入一个新时代!
第一三共
由于DESTINY-Breast01优异的临床数据,Trastuzumab Deruxtecan将会是一个市场变革者,将凭借Trastuzumab Deruxtecan vs. T-DM1头对头,快速进入二线用药,重建标准疗法,同时不断向HER2低表达乳腺癌和其他瘤种拓展。
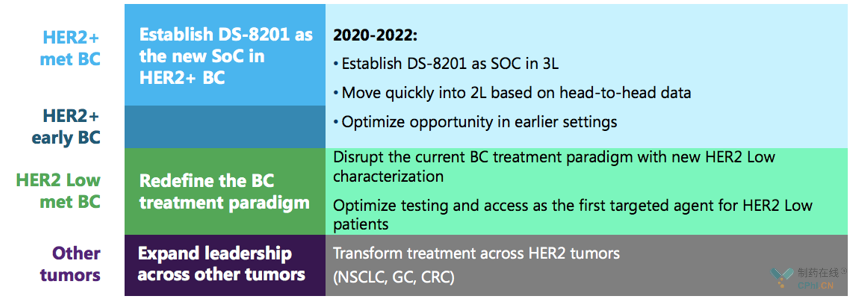
第一三共
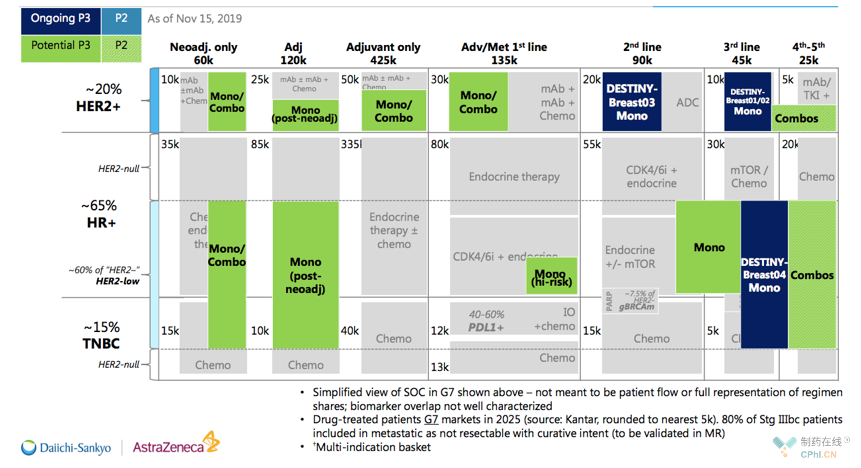
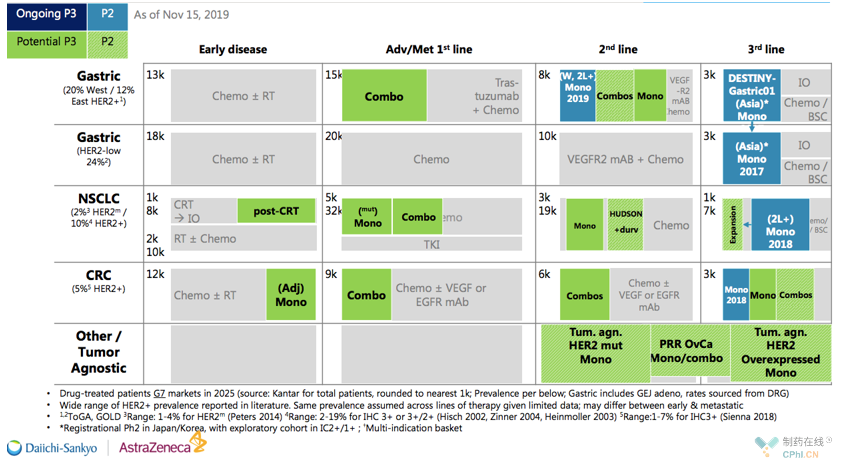
最后是2张第一三共官网摘出来的关于Trastuzumab Deruxtecan的宏伟蓝图:
乳腺癌适应症
非乳腺癌适应症
《2019中国医药关键词:创新药预计超40款 生物类似药时代开启》文章中指出,中国创新药:仍缺乏真正意义上的first-in-class,倒是有今又生这类中国特色药物。特瑞普利单抗为代表的PD-1单抗可算是fast-follower!多个国内创新的PD-1单抗纷纷以r/r-霍奇金淋巴瘤2期临床数据获批上市,但是,时间仍比First-in-class全球首批的时间滞后4年5个月!
中国近年个别获批上市创新药物分析
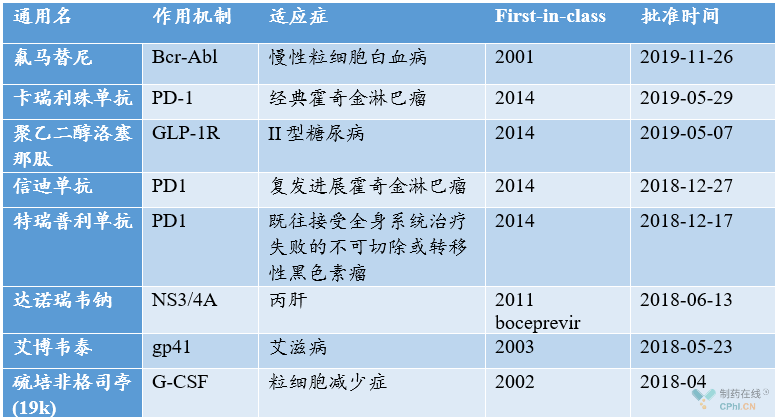
引自《2019中国医药关键词:创新药预计超40款 生物类似药时代开启》
创新从来都是九死一生,明显看出,国内创新环境在不断发生变革,期待中国逐步从仿制到me-too,从me-too到fast-follower,从fast-follower到me-better,从me-better到first-in-class!!!
只有国内创新跟上,中国患者对重磅创新药才能最终可及,医药创新突破才能真正惠及国内患者。
作者简介:1°C,医药行业从业人员,希望自己的专业文字会越来越有温度,医药知识能够服务更多人,打破信息知识的壁垒!
版权所有,未经允许,不得转载。
投稿合作联系方式: Kelly.Xiao@imsinoexpo.com 021-33392297
地址:上海市徐汇区虹桥路355号城开国际大厦7-8楼 200030