截止到2019年11月29日,今年FDA共批准42款新药、9款生物类似药,另外还有3款新药的PDUFA时间在12月,预计2019年将有45款新药获得FDA批准。相较于2017年和2018年,2019年会是FDA批准新药数量最低的一年,但质量不差,比如Skyrizi、Zolgensma、Rozlytrek和Brukinsa。本文总结了2019年FDA批准的42款新药、9款生物类似药,以及12月份面临FDA决定的3款新药。
► 当前FDA批准42款新药,刷新3年来低点
截止到11月29日,2019年FDA共批准42款新药, 2017年和2018年FDA分别批准了57款和62款新药,2019年可以说是FDA批准新药的"惨淡"一年。2018年年末至2019年年初,美国政府历经数次停摆;另外,FDA前任局长Scott Gottlieb辞职在生物制药行业引起震荡,这些都可能影响新药审批。
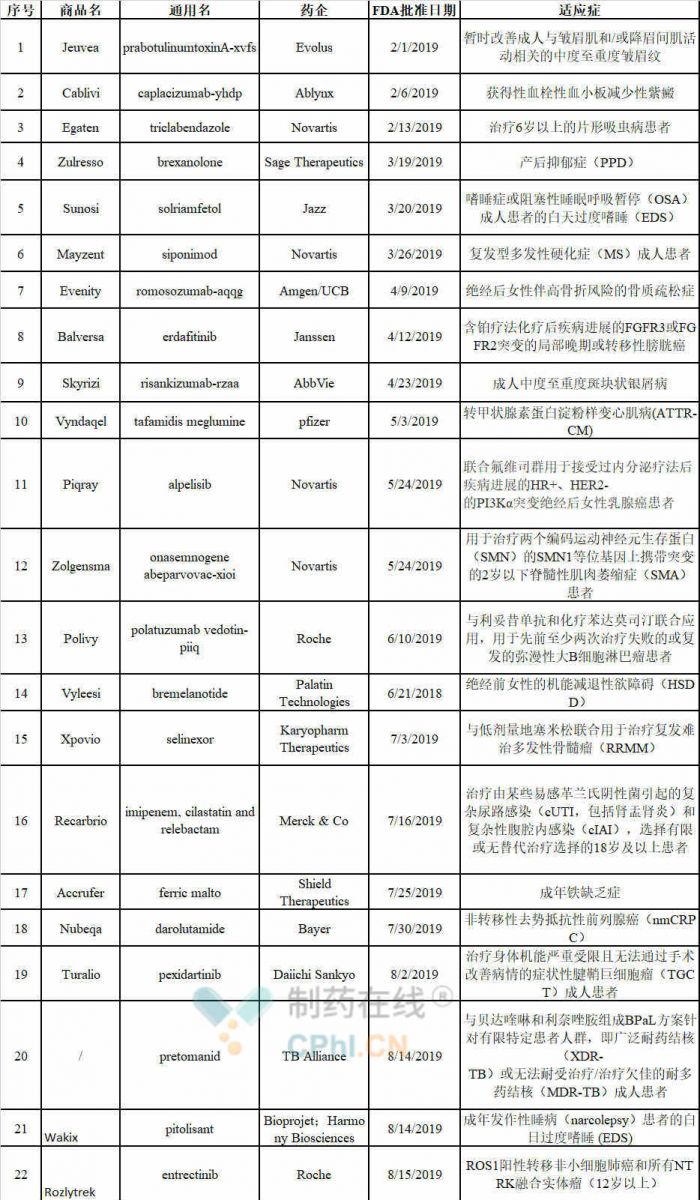
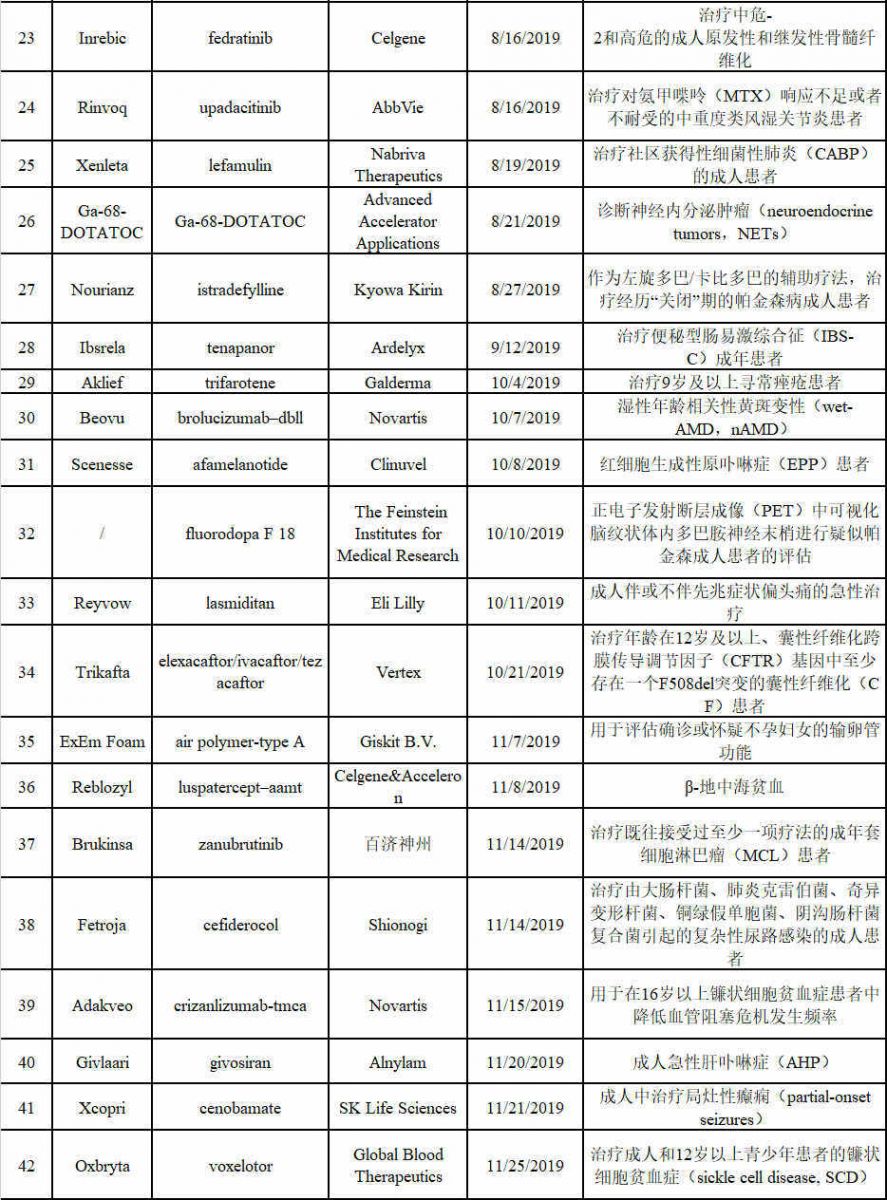
表1 截止到2019年11月29日 FDA批准42款新药
虽说数量上略显不足,但质量上却一点也不差,例、如最有价值的银屑病新药Skyrizi基因疗法Zolgensma、广谱抗癌药Rozlytrek和百济神州首款FDA新药Brukinsa,同样还有多款疾病领域中的首款产品。
• 非常有价值的银屑病新药Skyrizi
2019年4月23日,FDA批准白细胞介素-23(IL-23)抑制剂Skyrizi(risankizumab-rzaa)治疗成人中度至重度斑块状银屑病。银屑病又被称为"牛皮癣",是一种很普遍的自身免疫性疾病。分析师预计,2024年Skyrizi的年销售额将达到31.96亿美元,被称为2019年FDA批准的最具价值的新药。
获得批准后,Skyrizi将进入一个十分拥挤的市场,竞争对手包括Taltz、Siliq、Tremfya、Ilumya等。其中,Tremfya、Ilumya是和Skyrizi类似的选择性靶向IL-23的生物疗法。
Skyrizi是这类药物中疗效最好的,将有利于该药的上市推广,其Ⅲ期临床研究结果出众,接受Skyrizi治疗的患者中,银屑病免疫及严重度指数(PASI)改善90%的患者比例达到75%左右。
此外,Skyrizi的优势不仅在于疗效上,还在于使用非常便利。患者在第一次使用Skyrizi后,第二次用是4周后,此后的患者每年只需要注射4次,而Tremfya需要每8周注射一次,患者经过培训后还能自行注射Skyrizi。
• 基因疗法Zolgensma--史上最贵药物
2019年5月24日, FDA批准基因疗法Zolgensma上市,用于治疗2岁以下患有SMN1等位突变导致的脊髓性肌萎缩症(SMA)的儿童患者,一次性费用212.5万美元。
Zolgensma是一款一次性基因替代疗法,通过9型腺相关病毒(AAV9)将正常SMN1基因导入患者体内,取代缺陷型SMN1基因,从而可以有效合成功能正常的SMN蛋白。与此前FDA批准的另一款SMA基因疗法Spinraza相比,Zolgensma(AVXS-101)无论在疗效还是成本效益上都具有优势。
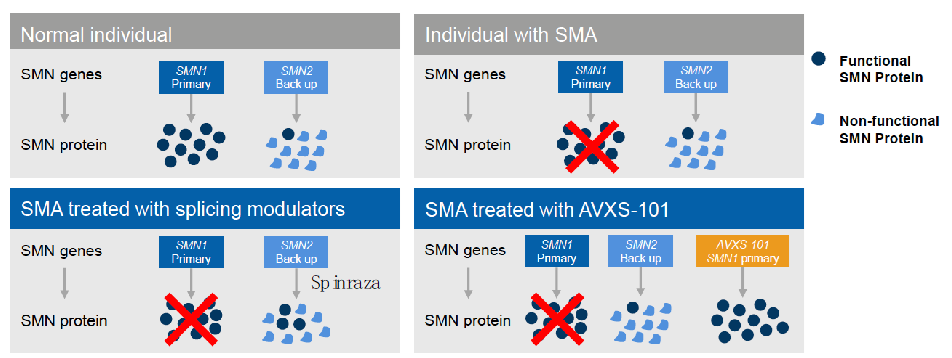
Spinraza和Zolgensma的治疗思路
• 第三款广谱抗癌药Rozlytrek
2019年8月15日,FDA宣布加速批准Roche开发的Rozlytrek(entrectinib)上市,治疗携带NTRK基因融合的成年和青少年癌症患者,这些患者没有其它有效治疗方法。
Rozlytrek是一款针对NTRK和ROS1基因融合而设计的特异性酪氨酸激酶抑制剂,它能够抑制TRK A/B/C和ROS1激酶活性。Rozlytrek已经于今年6月在日本首次获批上市,治疗携带NTRK基因融合的晚期复发性实体瘤患者。
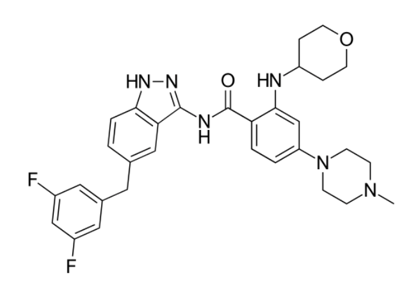
Rozlytrek分子式(图片来源于Wikipedia)
Rozlytrek是继Keytruda和Vitrakvi之后,FDA批准的第三款"不限癌种"的广谱抗癌疗法,其靶向驱动癌症的特定基因特征,而不是肿瘤起源的组织类型
• 百济神州首款FDA新药Brukinsa
2019年11月14日,百济神州(BeiGene)宣布Brukinsa(泽布替尼)获得FDA加速批准,于治疗既往接受过至少一项疗法的成年套细胞淋巴瘤(MCL)患者,其是第一个在美获批上市的中国本土自主研发抗癌新药,改写了中国抗癌药'只进不出'的尴尬历史。
Brukinsa是一款由百济神州自主开发的布鲁顿氏酪氨酸激酶(BTK)小分子抑制剂,目前正在全球进行广泛的关键性临床试验项目,作为单药和与其他疗法进行联合用药治疗多种B细胞恶性肿瘤。
Brukinsa用于治疗复发/难治性(R/R)MCL患者和R/R慢性淋巴细胞白血病(CLL)或小淋巴细胞淋巴瘤(SLL)患者的两项新药上市申请(NDA)已被NMPA纳入优先审评。
• 多个领域首款产品:
1)Egaten(Novartis):2019年2月13日,FDA批准首款治疗片形吸虫病疗法Egaten上市,用于治疗6岁以上的片形吸虫病患者。
2)Zulresso(Sage Therapeutics):2019年3月19日,FDA批准首款治疗产后抑郁症(PPD)新药Zulresso上市。
3)Vyndaqel(pfizer):2019年5月3日,FDA批准首款治疗转甲状腺素蛋白淀粉样变心肌病(ATTR-CM)新药Vyndaqel上市。
4)Turalio(Daiichi Sankyo):2019年8月2日,FDA批准首个也是唯一一个获准治疗腱鞘巨细胞瘤(TGCT)的药物Turalio。
5)Xenleta(Nabriva Therapeutics):2019年8月19日,FDA批准了近二十年来第一款具有新作用机制的静脉注射和口服抗生素Xenleta,适应症为社区获得性细菌性肺炎(CABP)。
6)Reblozyl(Celgene&Acceleron):2019年11月8日,FDA批准了首款治疗β-地中海贫血新药Reblozyl,β-地中海贫血主要见于地中海沿岸国家和东南亚各国,在我国南方地区高发。
7)Givlaari(Alnylam):2019年11月20日,FDA批准首款治疗成人急性肝卟啉症(AHP)的新药Givlaari上市,Givlaari先后获得EMA和FDA孤儿药认定、EMA快速审批程序资格、FDA突破疗法。
• 多个领域重大进展:
1)Mayzent(Novartis,2019-03-26):过去15年来FDA批准的首个也是唯一一个专门批准用于活动性继发进展型多发性硬化症(SPMS)的治疗药物。
2)Pretomanid(TB Alliance,2019-08-14):近40年来FDA批准的第三款抗肺结核新药,也是第一款由非盈利组织开发并且上市的肺结核新药。
3)Inrebic(Celgene,2019-08-16):近十年来首款骨髓纤维化新药。
4)Aklief(Galderma,2019-10-04):二十多年来首个获得美国FDA批准用于治疗痤疮的类维生素A分子。
5)Reyvow(Eli Lilly,2019-10-11):二十多年来FDA批准的首个新一类的急性偏头痛治疗药物。
• 三款诊断类新药:
1)Ga-68-DOTATOC(Advanced Accelerator Applications ,2019-08-21):其由正电子发射性核素镓-68,偶联生长抑素(somatostatin,SST)类似物DOTATOC构成,可用于诊断神经内分泌肿瘤(neuroendocrine tumors,NETs)。
2)fluorodopa F 18(The Feinstein Institutes for Medical Research ,2019-10-10):正电子发射断层成像(PET)中使用的一种**诊断试剂,用于可视化脑纹状体内多巴胺神经末梢进行疑似帕金森成人患者的评估。
3)ExEm Foam(Giskit B.V.,2019-11-07):用于评估确诊或怀疑不孕妇女的输卵管功能。
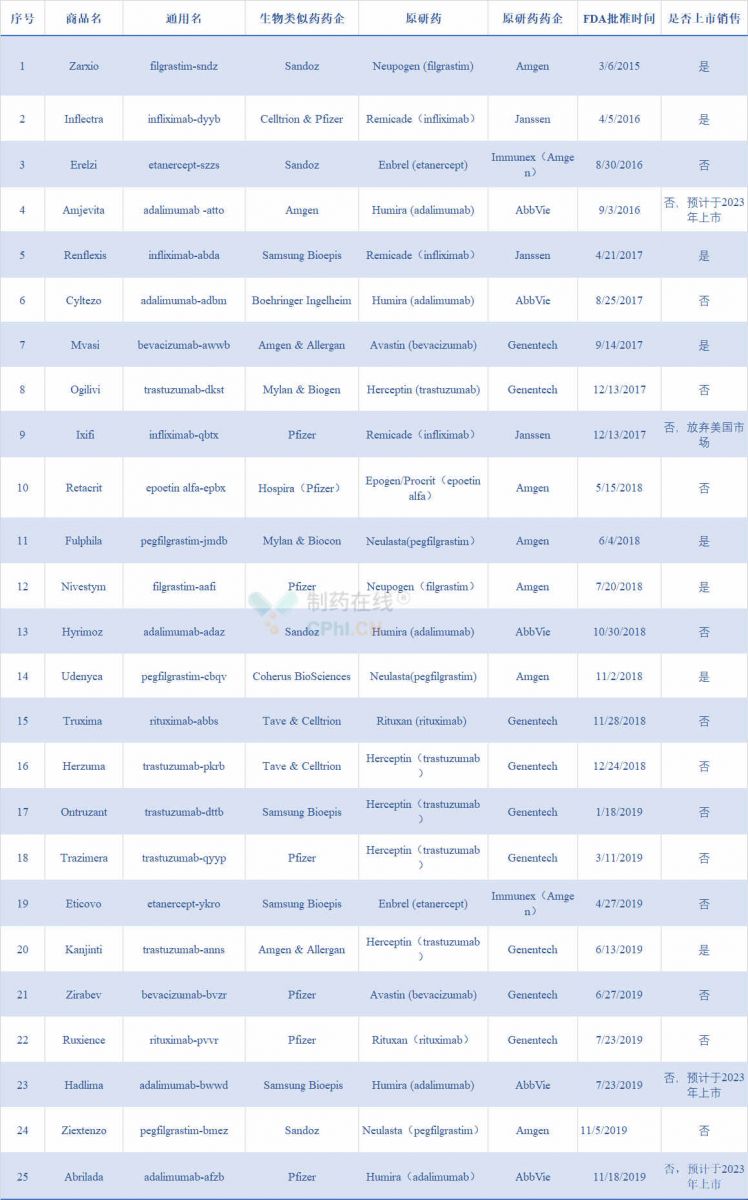
► 9款生物类似药,比去年多2款
截止到2019年11月29日, FDA共批准25款生物类似药,到目前为止2019年批准9款生物类似药,比2018年多两款,展现了FDA将持续推动生物制品竞争,将生物类似药引入市场的努力。生物类似药与FDA批准的生物制品(参比生物制品)高度类似,在临床上不存在显著差别。
2019年FDA批准的生物类似药的原研产品主要集中在Roche、AbbVie和Agmen手中,Roche:Herceptin(Ontruzant、Trazimera、Kanjinti),Avastin(Zirabev),Rituxan(Ruxience);AbbVie:Humira(Hadlima、Abrilada);Agmen:Enbrel(Eticovo),Neulasta(Ziextenzo)。
在FDA批准的全部25款生物类似药中,有5款Humira、5款Herceptin、2款Enbrel、2款Avastin、3款Remicade和3款Neulasta生物类似药。由于FDA和EMA对待生物类似药以及原研药专利保护采用不同的形式,生物类似药的发展在欧盟发展迅速,在美国发展缓慢,并非所有FDA批准的生物类似药都可以销售。
表2 截止到2019年11月29日 FDA批准25款生物类似药
► 3款新药PDUFA在12月,等待FDA决定
2019年还未走完,还留下12月这条尾巴,也还有3款候选药等待FDA的决定,分别为ubrogepant、Vascepa和lumateperone。如果这3款产品成功上市, 2019年FDA新药批准数量或为45款。
表3 PDUFA在2019年12月的3款候选药
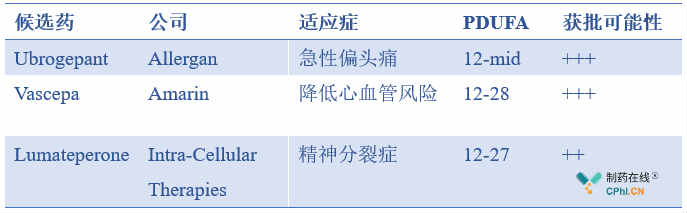
Ubrogepant是Allergan开发的一种新型、高效、口服降钙素基因相关肽(CGRP)受体拮抗剂,目前开发用于急性偏头痛的治疗。截至目前,已有3款靶向CGRP受体的单抗类偏头痛药物上市,分别为:Aimovig(erenumab-aooe,Amgen)、Ajovy(fremanezumab-vfrm,Teva)、Emgality(galcanezumab-gnlm,Eli Lilly)。与前3者相比,Ubrogepant为出现症状后用药,其他3款为预防性用药;Ubrogepant为口服用药,而其他3款均为皮下注射,Ubrogepant用药方面更具便利性。
Vascepa(二十碳五烯酸乙酯)胶囊,是经过严格的、复杂的、FDA监管的生产工艺从深海鱼中提取的高纯度EPA(二十碳五烯酸)单分子处方型产品, 2012年被FDA批准用于成人严重(>=500 mg/dL)高甘油三酯血症患者饮食的辅助治疗来降低其甘油三酯水平。
基于2018年REDUCE-ITTM试验结果,Amarin于2019年3月向FDA递交了降低心血管风险的补充新药申请。2019年5月29日,FDA已正式接受Vascepa用于降低心血管风险适应症的补充新药申请(sNDA),并同时授予了优先审评资格。
Lumateperone是Intra-Cellular Therapies(ICT)开发的首创(first-in-class)小分子药物,可选择性且同时调节5-羟色胺、多巴胺及谷氨酸这3种涉及严重疾病的神经递质通路。Lumateperone可能在一系列**症状方面具有疗效,具有改善的心理社会功能和良好的耐受性,有可能使罹患一系列神经**障碍和神经退行性疾病的患者受益。
目前,lumateperone治疗**分裂症的新药申请正在FDA的审查。ICT公司也正在开发lumateperone治疗其他**疾病,包括痴呆患者行为障碍、阿尔茨海默病、抑郁症和其他神经**和神经疾病。
参考来源:
1. FDA官网
2. Before 2019 closes, the FDA has 3 key approval decisions to make
作者简介:知行,用简单的语言讲述不简单的未来,一个不断前行的医药人。



合作咨询
![]() 肖女士
肖女士
![]() 021-33392297
021-33392297
![]() Kelly.Xiao@imsinoexpo.com
Kelly.Xiao@imsinoexpo.com
 2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57
2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57