https://www.cphi.cn 2022-01-06 09:26 来源:新浪医药新闻 作者:newborn
在2021年,美国FDA共批准了50款创新药物,2020年为53款。2018年创新药批准数量最多,达到了59款。在过去10年中,FDA平均每年批准43款创新药。
进入20221年1月份,有多款药物将迎来FDA的重要审查决定。以下是对这些药物进行的简单汇总。
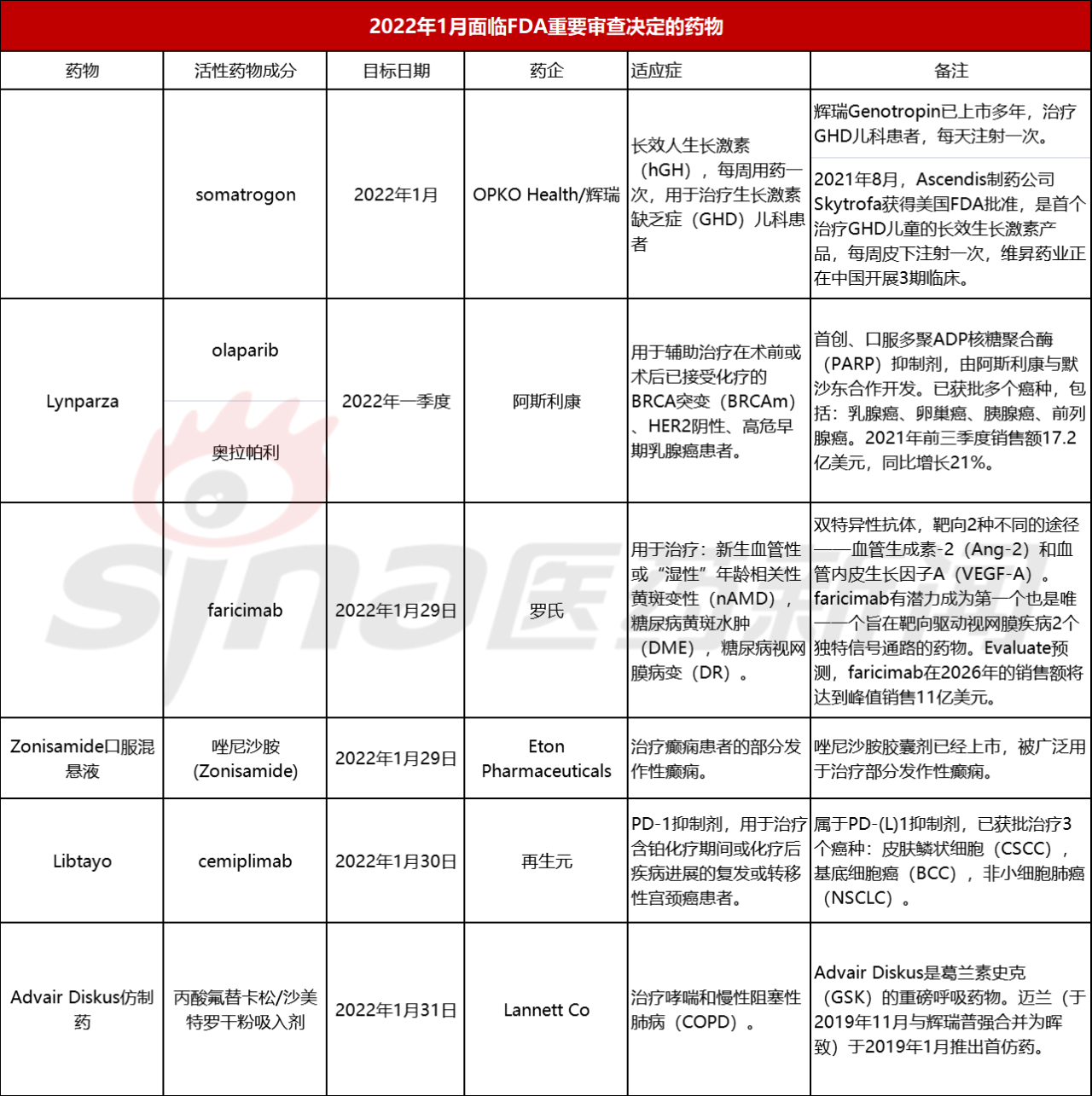
1、OPKO Health/辉瑞somatrogon
Somatrogon是一种新的分子实体,包含人类生长激素的天然序列和人绒毛膜hCGβ链的C端多肽(CTP)。CTP延长了生长激素的半衰期。Somatrogon在美国和欧盟获得了“孤儿药”称号,用于治疗生长激素缺乏症的儿童和成人。
Somatrogon的一项在20多个国家开展的随机、开放标签、阳性药物三期临床对照试验,入组并治疗了224例先前没有接受过治疗的GHD儿童患者。研究中,这些患者以1:1的比例随机分配至2个治疗组:somatrogon治疗组(0.66mg/kg,每周给药一次),Genotropin(somatropin)治疗组(0.034mg/kg,每天给药一次)。试验的主要终点是治疗12个月的身高生长速度(height velocity)。次要终点包括6个月和12个月时身高标准差的变化、安全性、药效学指标。完成该研究的儿童有机会参加一项全球性的、开放标签、多中心、长期扩展研究,在这项研究中,患者可以继续接受或改用somatrogon治疗。大约95%的患者已转入开放标签扩展研究,并接受了somatrogon治疗。
结果显示,该研究达到了非劣效性主要终点:治疗12个月,somatrogon组的最小二乘平均值(10.12 厘米/年)高于Genotropin组(9.78厘米/年);身高生长速度(厘米/年)的治疗差异(somatrogon-Genotropin)为0.33(双侧95%置信区间:-0.39,1.05)。与Genotropin组相比,somatrogon组在6个月和12个月时的身高标准差得分变化(关键次要终点)更高。此外,在6个月时,与Genotropin组相比,somatrogon组在另一个关键次要终点——身高生长速度变化更高。在临床环境中,这些常用的生长测量方法用于测量受试者可能经历的追赶年龄和性别匹配的同龄人身高生长的潜力。
该研究中,somatrogon的耐受性总体良好,在各治疗组之间观察到的不良事件的类型、数量和严重程度方面,与每天一次的生长激素Genotropin相当。
2、阿斯利康Lynparza
Lynparza是一种首创、口服多聚ADP核糖聚合酶(PARP)抑制剂,可利用肿瘤DNA损伤修复(DDR)通路的缺陷优先杀死癌细胞,这种作用模式赋予了Lynparza治疗存在DNA损伤修复缺陷(如BRCA1和/或BRCA2突变)的广泛类型肿瘤的潜力。
2017年7月,阿斯利康与默沙东达成肿瘤学全球战略合作,共同开发和商业化Lynparza及另一种MEK抑制剂selumetinib治疗广泛类型肿瘤,包括乳腺癌、前列腺癌、胰 腺癌。
Lynparza是全球上市的首 个PARP抑制剂,于2014年12月首次获美国FDA批准。截至目前,Lynparza已获批7个治疗适应症:(1)一线维持治疗BRCAm晚期卵巢癌成人患者;(2)联合贝伐单抗一线维持治疗HRD阳性晚期卵巢癌成人患者;(3)维持治疗复发性卵巢癌成人患者;(4)晚期gBRCAm卵巢癌成人患者;(5)治疗gBRCAm、HER2阴性(HER2-)转移性乳腺癌成人患者;(6)一线维持治疗gBRCAm转移性胰 腺癌成人患者;(7)治疗携带特定基因突变的转移性去势抵抗性前列腺癌(mCRPC)患者。
在中国,Lynparza(利普卓)于2018年8月获批,用于铂敏感复发性卵巢癌的维持治疗。2019年12月初,Lynparza(利普卓)再次获批,用于BRCA突变晚期卵巢癌患者的一线维持治疗。
3、罗氏faricimab
Faricimab是针对眼睛设计的双特异性抗体,通过阻断血管生成素 2(Ang-2)和血管内皮生长因子A(VEGF-A)两条途径来治疗多种视网膜疾病。Ang-2和VEGF-A通过破坏血管稳定性,导致新的渗漏血管形成,增加炎症反应,从而导致视力下降。
罗氏本次针对faricimab的BLA申请基于4项3期临床试验的积极结果,分别为针对湿性AMD患者的 ,以及针对DME患者的 。所有试验均达到其主要终点,显示与每两个月给药一次的当前标准治疗相比,每4个月给药一次faricimab达到非劣效性标准的视力获益。
并且,大约一半适合延长faricimab给药间隔的湿性AMD或DME患者,在接受治疗第一年时就只需每4个月接受一次给药。新闻稿指出,faricimab是首 个在湿性AMD和DME的3期临床试验中,达到这么长持久性的眼部注射药物。安全性方面,在所有4项试验中,faricimab通常耐受良好,未发现新/非预期安全性信号。
参考来源:
1.Biotech Stocks Facing FDA Decision In January 2022
2.生物谷、药明康德等
如果这篇文章侵犯了您的权利,请联系我们。
投稿合作联系方式: Kelly.Xiao@imsinoexpo.com 021-33392297
地址:上海市徐汇区虹桥路355号城开国际大厦7-8楼 200030