https://www.cphi.cn 2020-04-20 15:44 来源:新浪医药新闻
1类生物药临床审批概况
2020年3月,共有6个中国1类治疗用生物制品获得国家药品监督管理局(NMPA)的临床试验默示许可,具体信息如下表所示
01 重组抗VEGF人源化单克隆抗体注射液
百奥泰生物开发的重组抗VEGF人源化单克隆抗体,拟用于治疗眼部疾病。2019年12月百奥泰向国家药品监督管理局(NMPA)递交了临床试验申请(治疗用生物制品1类),并于2020年3月获得临床试验默示许可,用于治疗糖尿病性黄斑水肿(DME)。
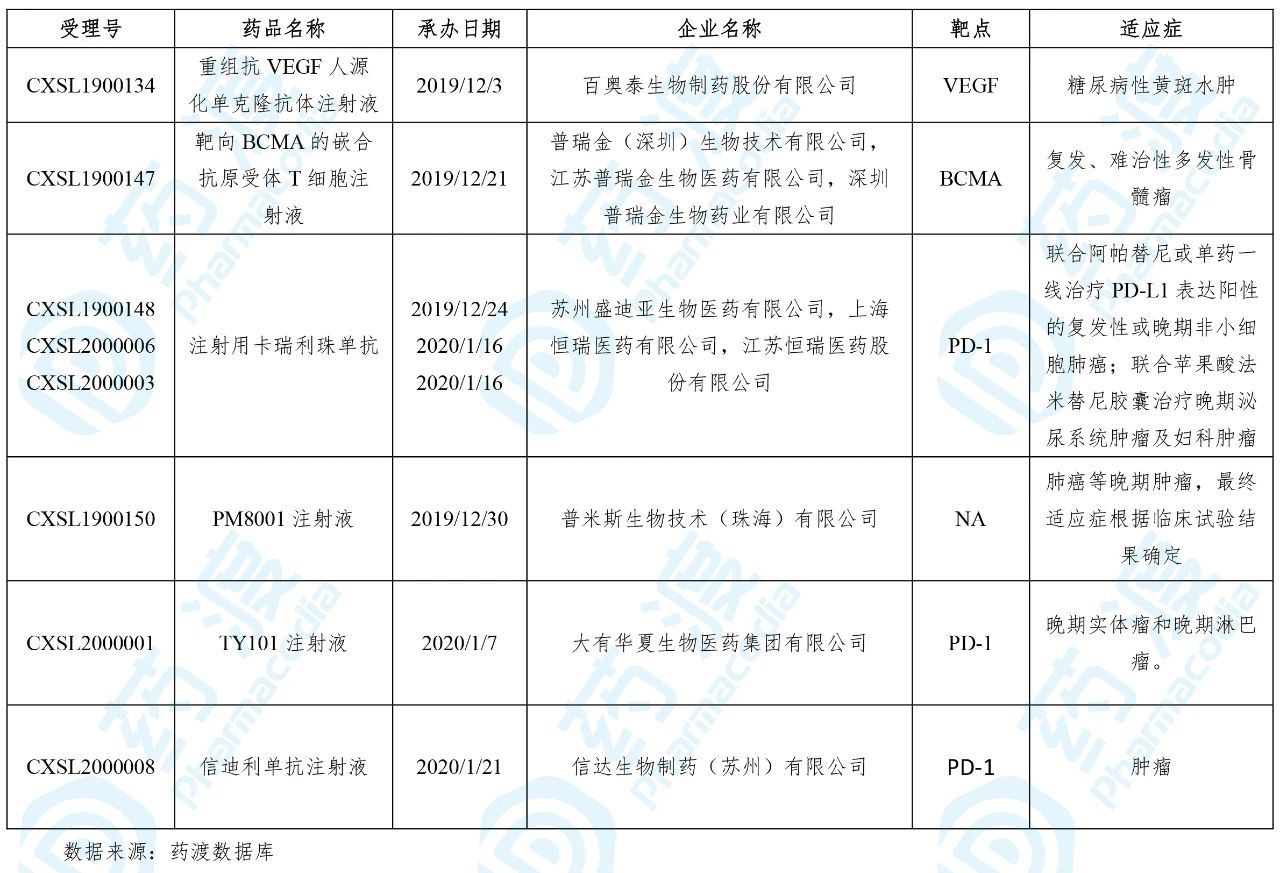
目前靶向VEGF的中国1类药物如下表所示:
02 靶向BCMA的嵌合抗原受体T细胞注射液
靶向BCMA的嵌合抗原受体T细胞由普瑞金生物研发并于2019年12月向国家药品监督管理局(NMPA)递交了临床试验申请(治疗用生物制品1类)。2020年3月获得临床试验默示许可,用于治疗复发、难治性多发性骨髓瘤。
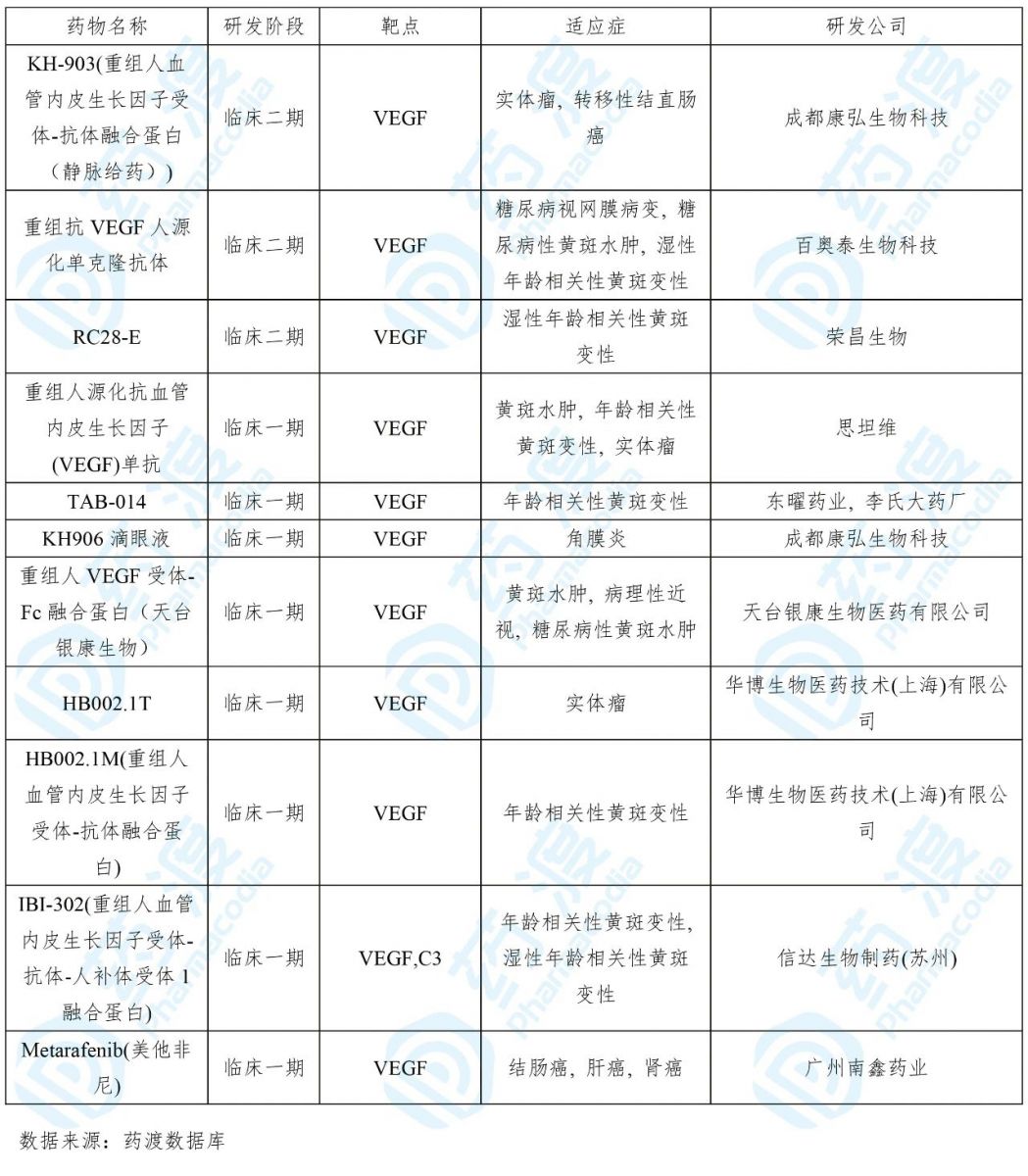
目前靶向BCMA的中国1类药物如下表所示:
03 注射用卡瑞利珠单抗
卡瑞利珠单抗(SHR-1210)是由江苏恒瑞研发的一种靶向于程序性细胞死亡因子1(PD-1)的人源化单克隆抗体,于2019年5月29日获国家药品监督管理局(NMPA)批准上市,商品名为艾瑞卡?,用于治疗既往接受过至少二线系统性治疗的复发/难治性经典型霍奇金淋巴瘤(cHL)患者。2020年3月获批用于治疗接受过索拉非尼治疗和/或含奥沙利铂系统化疗的晚期肝细胞癌患者。此外复发或转移性鼻咽癌、晚期食管癌、复发或难治性结外NK/T细胞淋巴瘤(鼻型)、非小细胞肺癌、晚期泌尿系统肿瘤、妇科肿瘤、软组织肉瘤、胃食管交界癌、转移性结直肠癌、小细胞肺癌等实体瘤的研究也在进行中。
2019年12月和2020年1月恒瑞向国家药品监督管理局(NMPA)递交了多项临床试验申请(治疗用生物制品1类),并于2020年3月获得临床试验默示许可,用于联合阿帕替尼或单药一线治疗PD-L1表达阳性的复发性或晚期非小细胞肺癌以及联合苹果酸法米替尼胶囊治疗晚期泌尿系统肿瘤及妇科肿瘤。
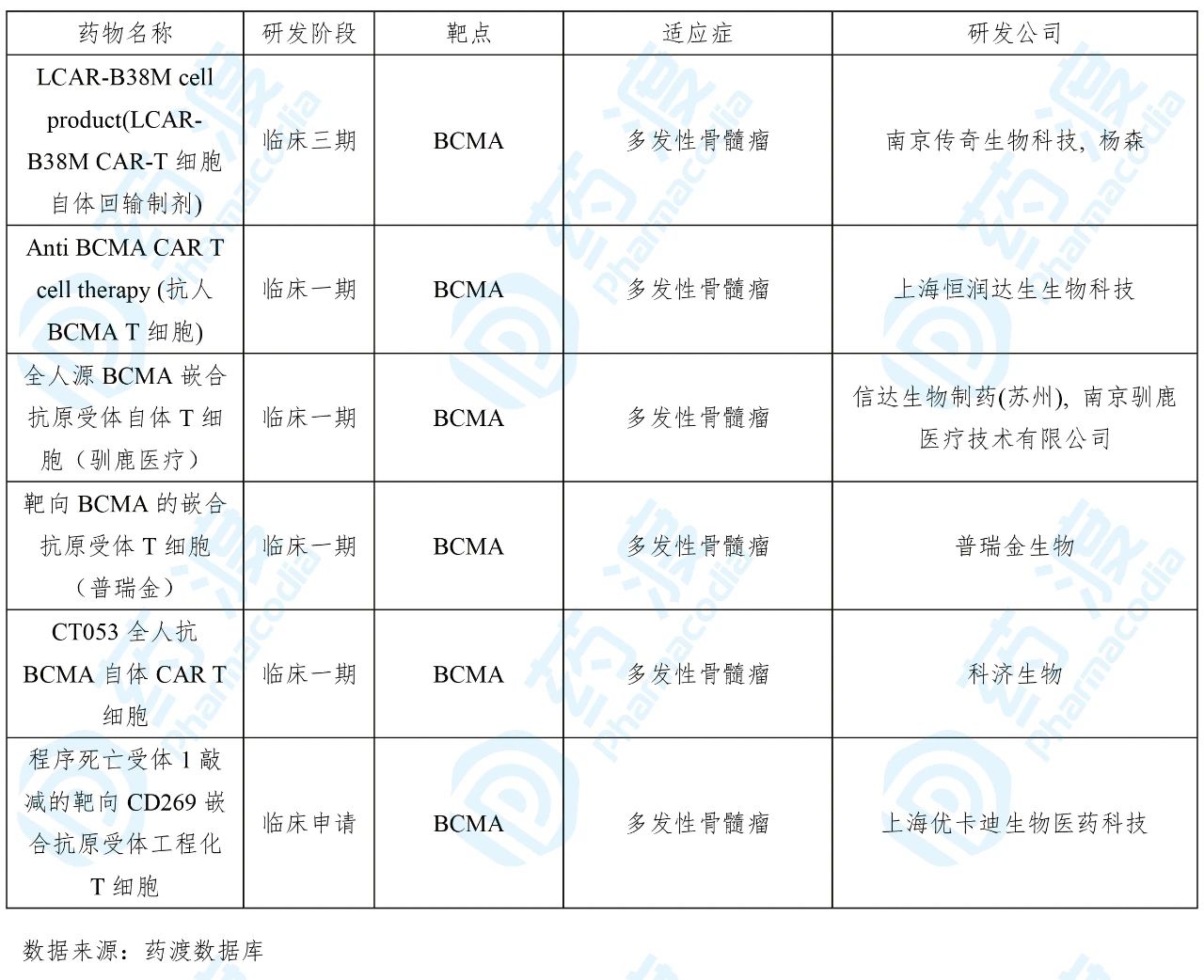
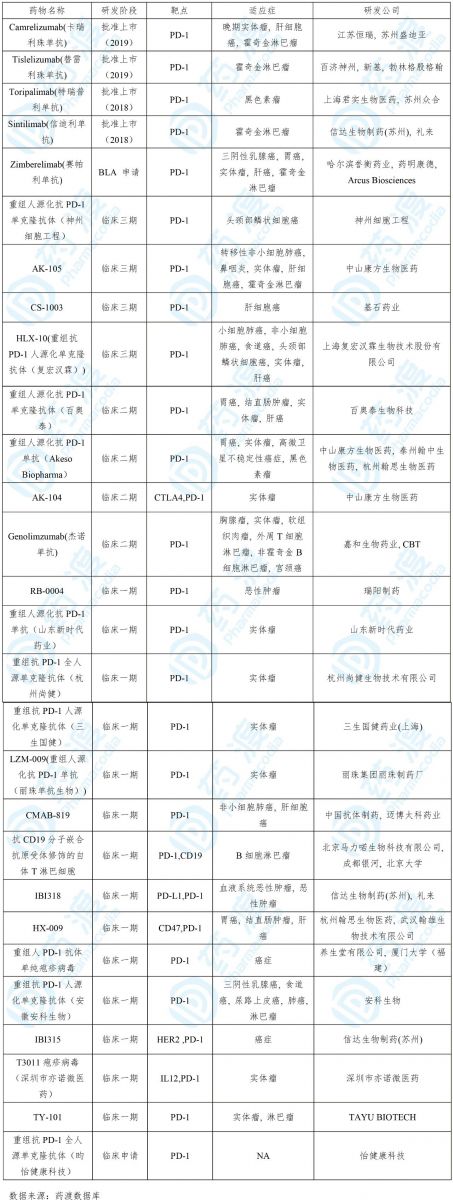
目前靶向PD-1的中国1类药物如下表所示:
04 PM8001注射液
PM-8001是由普米斯研发的一种双特异性抗体,由普米斯于2019年12月向国家药品监督管理局(NMPA)递交了临床试验申请(治疗用生物制品1类)。2020年3月获得临床试验默示许可,用于治疗肺癌等晚期肿瘤,最终适应症根据临床试验结果确定。
05 TY101注射液
TY-101是由大有生物研发的抗PD-1单克隆抗体,并于2020年1月由大有生物向国家药品监督管理局(NMPA)递交了临床试验申请(治疗用生物制品1类)。2020年3月获得临床试验默示许可,用于治疗晚期实体瘤和晚期淋巴瘤。
06 信迪利单抗注射液
信迪利单抗(IBI-308)是信达生物开发的一种全人源单克隆抗体,靶向于程序性死亡受体1(PD-1),通过阻断体内PD-1与配体PD-L1之间的结合,使T细胞发挥正常作用,进而利用自身免疫清除肿瘤细胞。信迪利单抗用于至少经过二线系统化疗的复发或难治性经典型霍奇金淋巴瘤的治疗于2018年12月24日获NMPA批准上市,商品名为达伯舒?(Tyvyt?),此外,治疗晚期或转移性鳞状非小细胞肺癌、胃及胃食管交界处腺癌的研究,现处于临床III期。2020年1月信达生物向国家药品监督管理局(NMPA)递交了临床试验申请(治疗用生物制品1类)。2020年3月获得临床试验默示许可,用于治疗肿瘤。
中国1类新药NDA申请概况
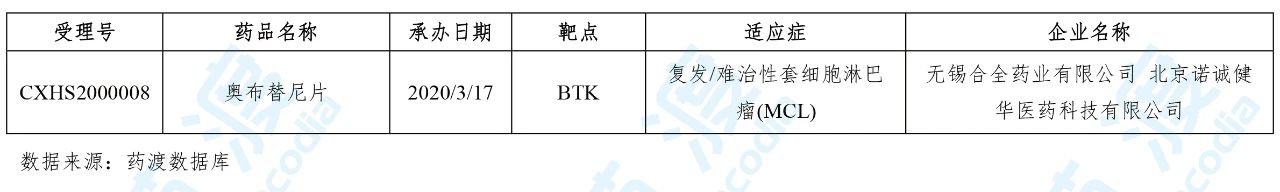
2020年3月,国家药品监督管理局(NMPA)药审中心共承办了1个中国1类新药的NDA申请,具体信息如下表所示:
01 奥布替尼片
奥布替尼是诺诚健华医药研发的BTK抑制剂,目前其用于治疗慢性淋巴细胞白血病(CLL)、小淋巴细胞淋巴瘤(SLL)和套细胞淋巴瘤(MCL)的新药上市申请(NDA)已被中国国家药品监督管理局(NMPA)受理。此外,本品也正在进行治疗类风湿性关节炎(RA)和系统性红斑狼疮(SLE)的一期临床研究以及联合重组人源化II型CD20单克隆抗体MIL62注射液治疗复发/难治CD20+B细胞淋巴瘤的一期临床研究。同时,本品还拟用于治疗复发难治性边缘区淋巴瘤(MZL)和华氏巨球蛋白血症等。
研发里程碑
2020年3月,该药治疗复发/难治性套细胞淋巴瘤的上市申请获得NMPA受理。
2020年1月2日,该药用于治疗慢性淋巴细胞白血病(CLL)和小淋巴细胞淋巴瘤(SLL)的上市申请被CDE纳入优先审评程序。
2019年11月20日,诺诚健华宣布,中国国家药品监督管理局(NMPA)已受理奥布替尼(ICP-022)用于治疗复发/难治慢性淋巴细胞白血病(CLL)/小淋巴细胞淋巴瘤(SLL)患者的新药上市申请(NDA)。
2019年5月,在美国的IND通过FDA审评。
2019年2月,评价ICP-022治疗复发或难治华氏巨球蛋白血症的临床II期试验(CTR20190364)拟在中国开始。
2019年1月,一项对复发难治边缘区淋巴瘤的II期临床研究计划2019年2月在中国开始。
2018年4月,对复发/难治性CLL或者SLL患者的临床I/II期试验(NCT03493217、CTR20180263、ICP-CL-00103)在中国开始,预计将于2020年12月完成。
2018年2月,一项评价ICP-022 治疗复发或难治性套细胞淋巴瘤安全性和有效性的多中心、开放性的临床I/II试验(NCT03494179、ICP-CL-00102、CTR20180196)在中国开始,预计将于2020年12月完成。
2017年7月,一项随机、双盲、安慰剂对照的单中心剂量递增临床I期试验(NCT03189017)在澳大利亚RA和SLE患者中启动,于2017年12月公开消息显示,ICP-022在该研究中显示了良好的安全性和药代药效动力学特性,对治疗类风湿关节炎和系统性红斑狼疮具有良好前景。
2017年6月12日,北京诺诚健华医药科技有限公司首次向中国食品药品监督管理总局(CFDA)提交临床试验申请(化药1类),并于2018年12月19日,获得CFDA批准开展针对系统性红斑狼疮(SLE)和类风湿关节炎(RA)的临床试验。
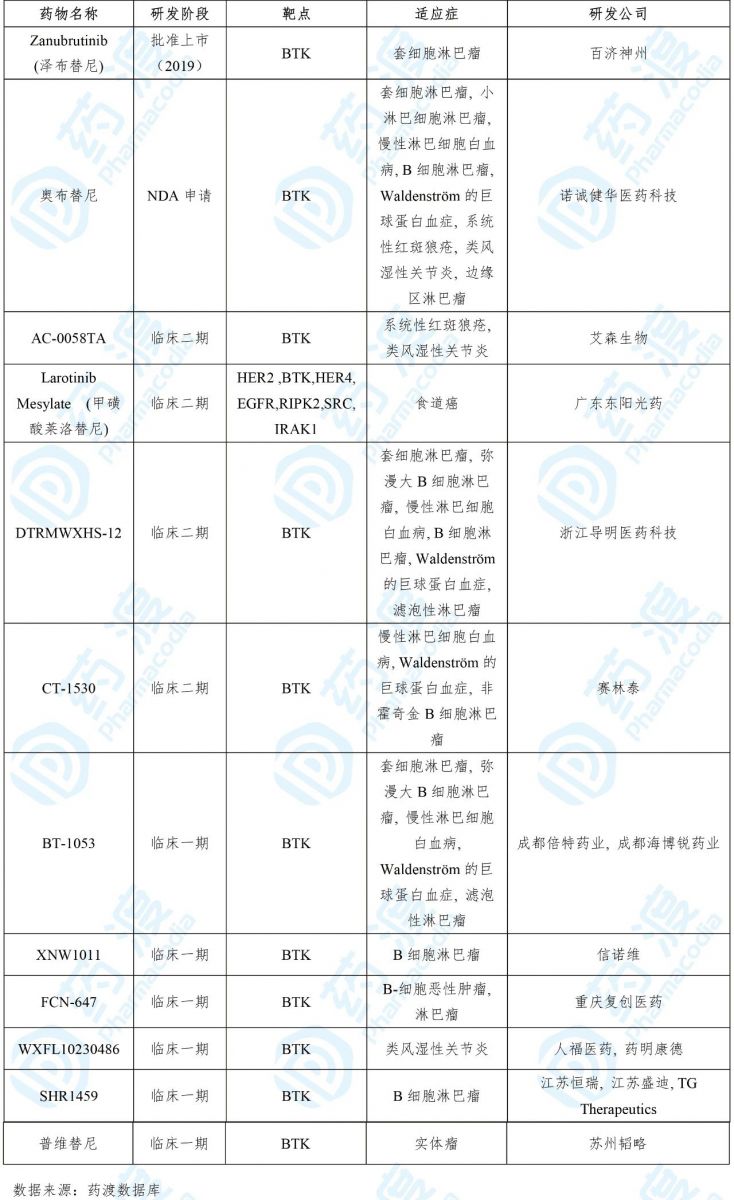
目前靶向BTK的中国1类药物如下表所示:
如果这篇文章侵犯了您的权利,请联系我们。
投稿合作联系方式: Kelly.Xiao@imsinoexpo.com 021-33392297
地址:上海市徐汇区虹桥路355号城开国际大厦7-8楼 200030