1类化药临床审批概况
2020年3月,共有19个中国1类化药获得国家药品监督管理局(NMPA)的临床试验默示许可,具体信息如下表所示:
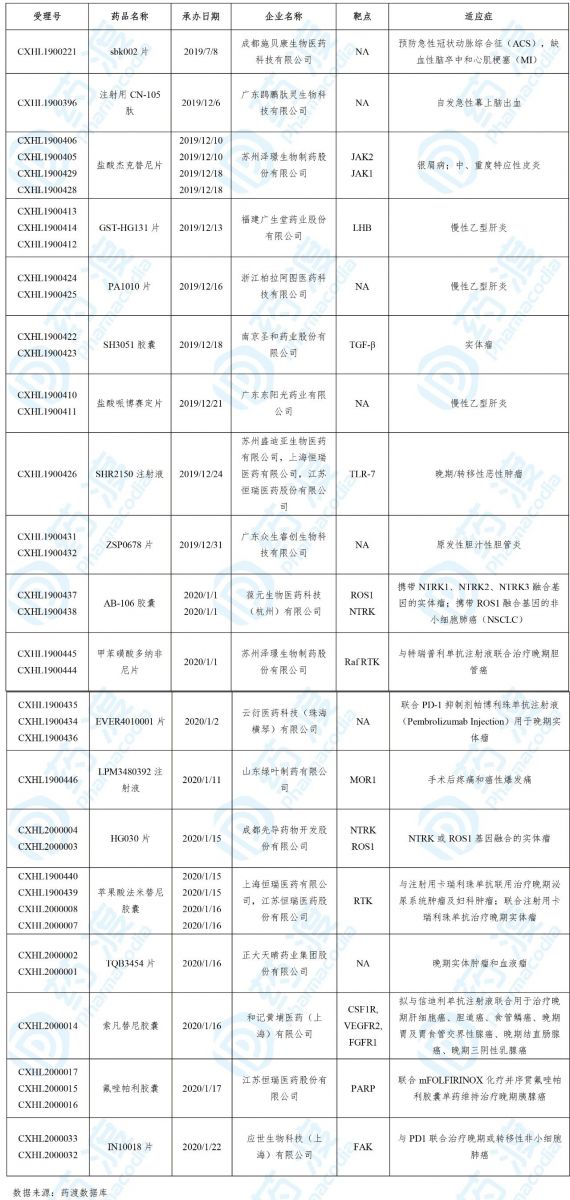
01 sbk002片
sbk002由成都施贝康生物医药科技有限公司开发,于2019年7月向国家药品监督管理局(NMPA)递交了临床试验申请(化药1类),并于2020年3月获得临床试验批件,用于预防急性冠状动脉综合征(ACS),缺血性脑卒中和心肌梗塞(MI)。
02 注射用CN-105肽
注射用CN-105肽由广东鹍鹏肽灵生物科技有限公司研发并于2019年12月向国家药品监督管理局(NMPA)递交了临床试验申请(化药1类)。2020年3月获得临床试验默示许可,用于治疗脑出血。
03 盐酸杰克替尼片
盐酸杰克替尼是泽璟制药研发的一种选择性JAK抑制剂,目前处于临床二期,用于治疗骨髓纤维化和斑秃,包括原发性骨髓纤维化(PMF)、真性红细胞增多症后骨髓纤维化(PPV-MF)或后原发性血小板增多症后骨髓纤维化(PET-MF)。此药品还处于治疗癌症的临床二期研究。
2019年12月泽璟生物向国家药品监督管理局(NMPA)递交了多项临床试验申请(化药1类),并于2020年3月获得临床试验默示许可,适应症分别为银屑病和中、重度特应性皮炎。
研发里程碑
2020年1月1日,该药的IND申请获得国家药品监督管理局(NMPA)承办,为化药一类。
2019年12月18日,该药的IND申请获得国家药品监督管理局(NMPA)承办,并于2020年3月获得NMPA临床试验批件用于治疗特应性皮炎。
2019年12月9日,该药的IND申请获得国家药品监督管理局(NMPA)承办,并于2020年3月获得NMPA临床试验批件用于治疗银屑病。
2019年11月,该药的IND申请(化药一类)获得中国国家药品监督管理局受理,并于2020年1月获得临床试验默示许可,用于治疗特发性肺纤维化、强直性脊柱炎以及中、重度活动性类风湿性关节炎。
2018年11月,评估安全性和有效性的治疗骨髓纤维化的临床二期试验在中国开始(NCT03886415)。
2017年9月,单次和多次口服盐酸杰克替尼片或安慰剂片的随机、双盲、剂量递增的耐受性、药代动力学和食物影响临床I期研究(CTR20170573)在中国开始。
2016年4月,由苏州泽璟生物制药有限公司联合上海泽璟医药技术有限公司向CFDA提交临床试验申请(化药一类),并于2016年12月获得临床试验批件,批件号为:2016L10574(0.1g规格)和2016L10575(50mg规格),获准进入I/II/III期临床研究。
融资及交易
2018年1月15日,泽璟制药完成4亿元人民币的B轮融资。此轮融资由民生保险、深创投和分享投资领投,北极光创投、中青国融等共同参与投资。
2016年8月1日,泽璟制药完成A轮融资,金额未公开,投资方国家中小企业发展基金。
2016年4月1日,泽璟制药完成天使轮融资,金额未公开,投资方盈富泰克。
04 GST-HG131片
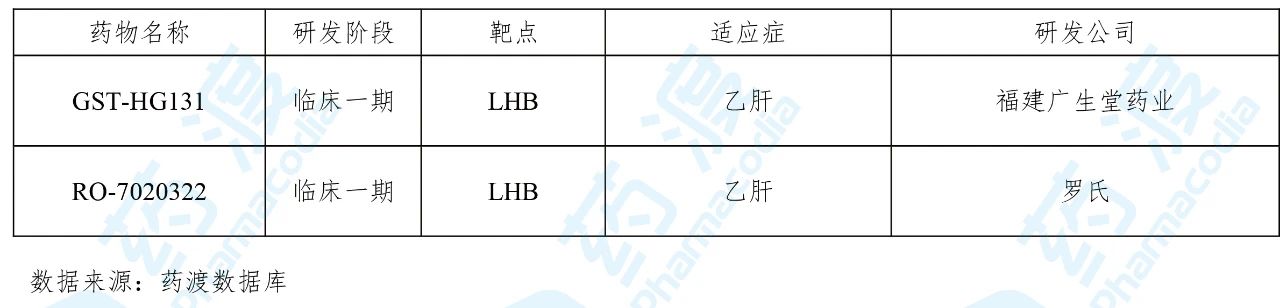
GST-HG131是由福建广生堂药业研发的乙肝表面抗原HBsAg(LHB)抑制剂,能够诱导HBV-RNA降解,快速大幅降低HBsAg水平,拟用于治疗乙肝。2019年12月福建广生堂药业向国家药品监督管理局(NMPA)递交了临床试验申请(化药1类),并于2020年3月获得临床试验默示许可,用于治疗慢性乙型肝炎。
目前靶向LHB的中国1类药物如下表所示:
05 PA1010片
PA1010由浙江柏拉阿图医药科技有限公司研发并于2019年12月向国家药品监督管理局(NMPA)递交了临床试验申请(化药1类)。2020年3月获得临床试验默示许可,用于治疗慢性乙型肝炎。
06 SH3051胶囊
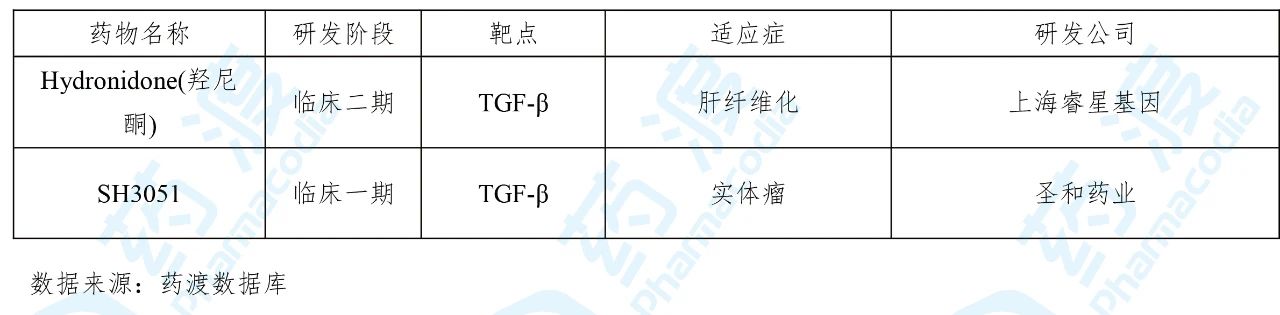
SH3051是由圣和药业研发的一种TGF-β抑制剂,并于2019年12月向国家药品监督管理局(NMPA)递交了临床试验申请(化药1类)。于2020年3月获得临床试验默示许可,用于治疗实体瘤。
目前靶向TGF-β的中国1类药物如下表所示:
07 盐酸哌博赛定片
盐酸哌博赛定由广东东阳光药研发并于2019年12月向国家药品监督管理局(NMPA)递交了临床试验申请(化药1类)。2020年3月获得临床试验默示许可,用于治疗慢性乙型肝炎。
08 SHR2150注射液
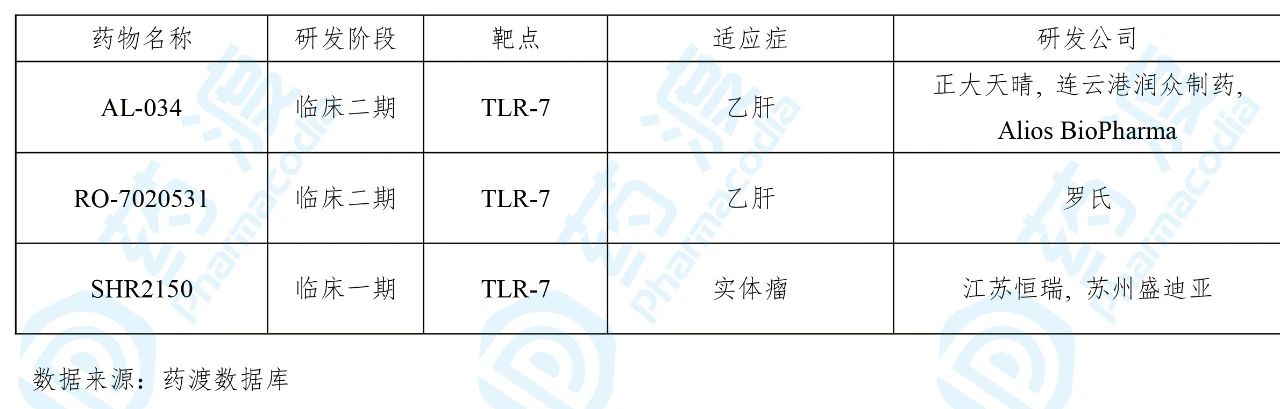
SHR2150由江苏恒瑞及其子公司苏州盛迪亚医药有限公司联合研发,是一种Toll样受体7(TLR-7)抑制剂。2019年12月该药的临床试验申请(化药1类)获得国家药品监督管理局(NMPA)承办,并于2020年3月获得临床试验默示许可,用于治疗晚期或转移性恶性肿瘤。
目前靶向TLR-7的中国1类药物如下表所示:
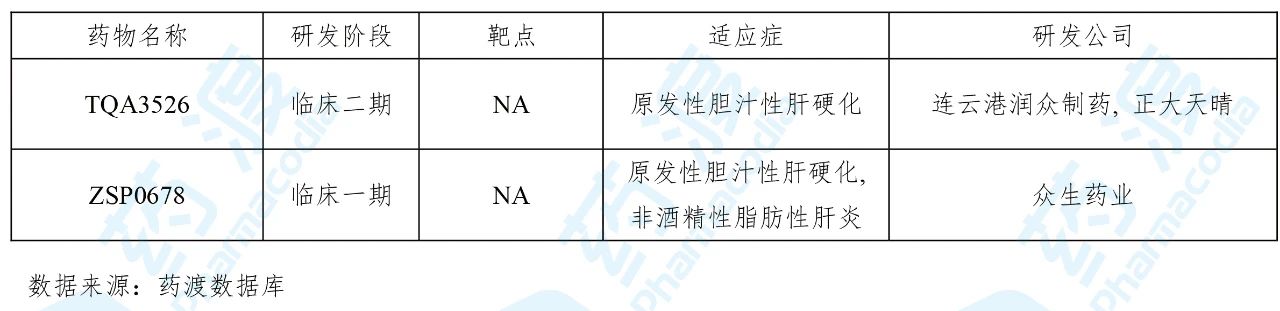
09 ZSP0678片
ZSP0678由广东众生药业研发并于 2019年12月向国家药品监督管理局(NMPA)递交了临床试验申请(化药1类)。2020年3月获得临床试验默示许可,用于治疗原发性胆汁性肝硬化(即原发性胆汁性胆管炎)。此外,该药还正在进行治疗非酒精性脂肪性肝炎(NASH)的临床一期试验。
目前治疗原发性胆汁性肝硬化的中国1类药物如下表所示:
10 AB-106胶囊
AB-106(DS-6051)是一种小分子ROS1/NTRK抑制剂,最初由日本第一三共制药研发。2018年12月,第一三共制药(Daiichi Sankyo)授予葆元生物该药全球开发、制造和商业化的独家权利。2020年1月葆元生物向国家药品监督管理局(NMPA)递交了两项临床试验申请(化药1类),并于同年3月获得临床试验默示许可,分别用于治疗携带NTRK1、NTRK2、NTRK3融合基因的实体瘤和携带ROS1融合基因的非小细胞肺癌。
11 甲苯磺酸多纳非尼片
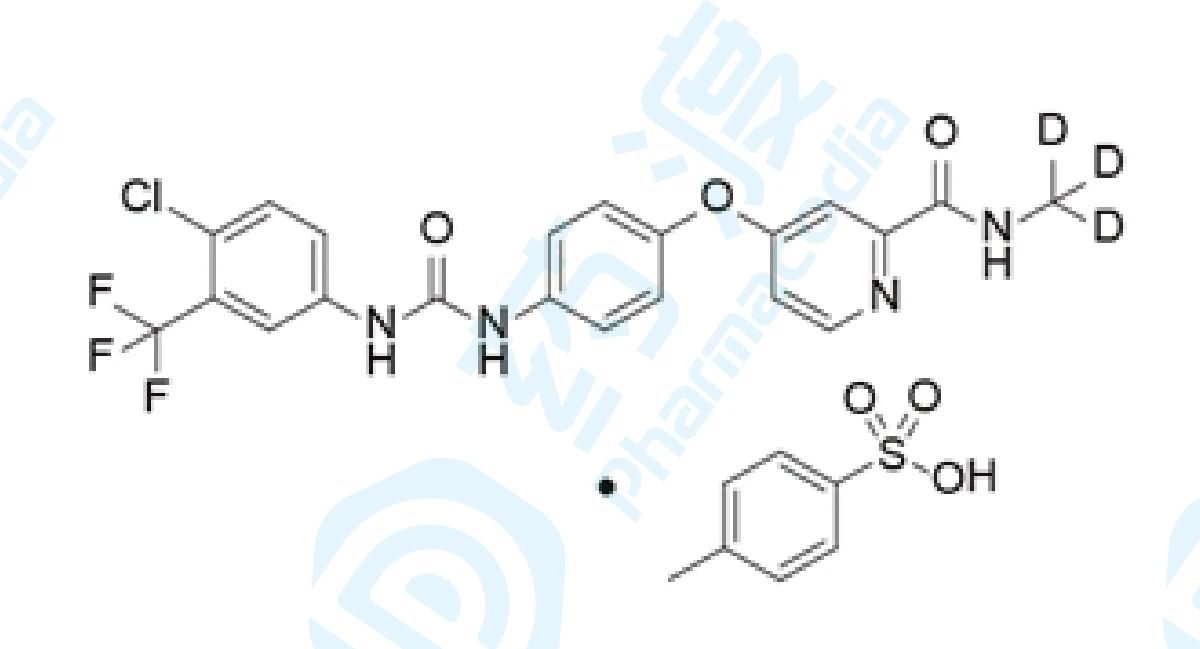
甲苯磺酸多纳非尼是泽璟生物研发的氘取代索拉非尼衍生物,是一款口服多激酶抑制剂,具有双重的抗肿瘤作用:通过抑制丝氨酸-苏氨酸激酶Raf从而抑制Raf/MEK/ERK信号传导通路而直接抑制肿瘤细胞的增殖;通过抑制VEGFR和血小板衍生生长因子受体(PDGFR)等受体酪氨酸激酶(RTK)阻断肿瘤新生血管的形成,间接抑制肿瘤细胞的生长。此药对肝细胞癌、晚期直肠癌及二线治疗局部晚期/转移性**碘难治性分化型甲状腺癌的研究,目前处于治疗大肠癌和甲状腺癌的临床三期研发阶段、肝癌的临床二/三期研究阶段、胃癌和食道癌的临床一/二期研发阶段和治疗鼻咽癌和非小细胞肺癌的临床一期研发阶段。
泽璟生物于2020年1月向国家药品监督管理局(NMPA)递交了临床试验申请(化药1类),并于同年3月获得临床试验默示许可,与特瑞普利单抗注射液联合治疗晚期胆管癌。
研发里程碑
2020年2月25日,该药的IND申请获得国家药品监督管理局(NMPA)承办,为化药一类。
2020年1月1日,该药的IND申请获得国家药品监督管理局(NMPA)承办,为化药一类。
2019年8月22日甲苯磺酸多纳非尼片的临床试验申请获得CDE承办,10月得到临床试验默示许可与特瑞普利单抗注射液联合治疗晚期肝细胞癌。2019年2月,JS001和CM4307联合开展治疗晚期肝细胞癌的临床研究。
2018年3月,评价甲苯磺酸多纳非尼片治疗局部晚期/转移性RAIR-DTC患者(n=204)的有效性和安全性的多中心、随机、双盲、安慰剂对照的Ⅲ期临床试验(CTR20180191、ZGDD3)在中国开展。
2016年12月,甲苯磺酸多纳非尼片治疗晚期结直肠癌的随机、双盲、安慰剂对照、多中心Ⅲ期临床研究(CTR20160482、ZGDC3、NCT02870582)在中国患者(n=510)中开始,以评估多纳非尼的疗效及安全性。
2016年11月,甲苯磺酸多纳非尼片治疗二线晚期鼻咽癌患者(n=44)的开放、单中心IB期临床研究(CTR20160252、 ZGDN1B、NCT02698111)在中国启动。
2016年3月,甲苯磺酸多纳非尼片一线治疗晚期肝细胞癌患者(n=600)的开放、随机、平行对照、多中心Ⅱ/Ⅲ期临床研究(NCT02645981、ZGDH3、CTR20160184)启动。
2015年10月,苏州泽璟委托泰格医药开展甲苯磺酸多纳非尼片关于肝细胞癌的III期临床研究。
2015年6月,甲苯磺酸多纳非尼片治疗二线以上晚期食管癌患者(n=19)的开放、单中心IB/II期临床研究(NCT02489201、ZGDE1B、 CTR20160257)启动。
2015年5月,甲苯磺酸多纳非尼片治疗二线以上晚期胃癌患者(n=17)的随机、开放、平行对照、单中心I/II期临床研究((NCT02489214、ZGDG1B、CTR20160190)在中国启动。
2011年12月,由苏州泽璟生物制药有限公司向中国食品药品监督管理总局(CFDA)提交的临床试验申请(化药1类)获CDE承办,且于2012年11月29日获得临床试验批件。
临床结果
甲苯磺酸多纳非尼片治疗晚期肝细胞癌(HCC)患者,临床II/III期试验(CTR20160184)中关于多纳非尼治疗晚期不可切除HCC的II期临床试验总体生存时间随访数据,于2017年9月在CSCO会议公布。公布结果显示,该研究入组的106例晚期不可切除HCC患者来自国内10家临床中心,随机分组后分别接受0.2g/次和0.3g/次、均为2次/d的多纳非尼口服治疗,其结果显示:多纳非尼0.2g/次组和0.3g/次组的中位总体生存时间分别长达12.6个月和11.8个月。其中在第16周,多纳非尼0.2g/次组(III期临床试验剂量)和0.3g/次组经独立影像学评估的疾病控制率分别为42.5%和40.9%,疗效差异无统计学意义。安全性方面,多纳非尼0.2g/次组和0.3g/次组维持初始剂量的中位生存时间分别为90d和72d,总体安全性良好。此研究表明,多纳非尼0.2g/次的口服剂量或将成为HCC治疗的新一线用药。
12 EVER4010001片
EVER-4010001由云衍医药科技(珠海横琴)有限公司研发并于2020年1月向国家药品监督管理局(NMPA)递交了临床试验申请(化药1类)。2020年3月获得临床试验默示许可,联合PD-1抑制剂帕博利珠单抗注射液(Pembrolizumab Injection)用于治疗晚期实体瘤。
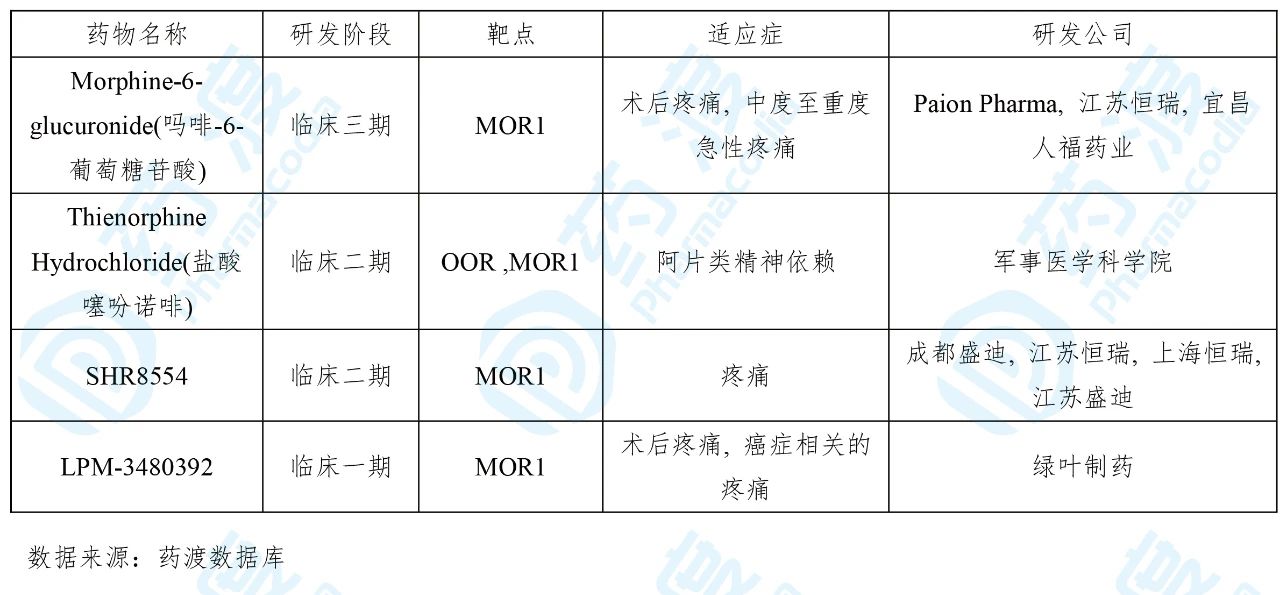
13 LPM3480392注射液
LPM-3480392是由绿叶制药研发的小分子Gi蛋白偏向性阿 片受体(MOR)激动剂。2020年1月绿叶制药向国家药品监督管理局(NMPA)递交了临床试验申请(化药1类)。2020年3月获得临床试验默示许可,用于手术后疼痛和癌性爆发痛的治疗。
目前靶向MOR1的中国1类药物如下表所示:
14 HG030片
HG-030是由成都先导药物开发公司研发的一种NTRK/ROS1抑制剂。2020年1月成都先导药物开发公司向国家药品监督管理局(NMPA)递交了临床试验申请(化药1类)。2020年3月获得临床试验默示许可,用于治疗NTRK或ROS1基因融合的实体瘤。
15 苹果酸法米替尼胶囊
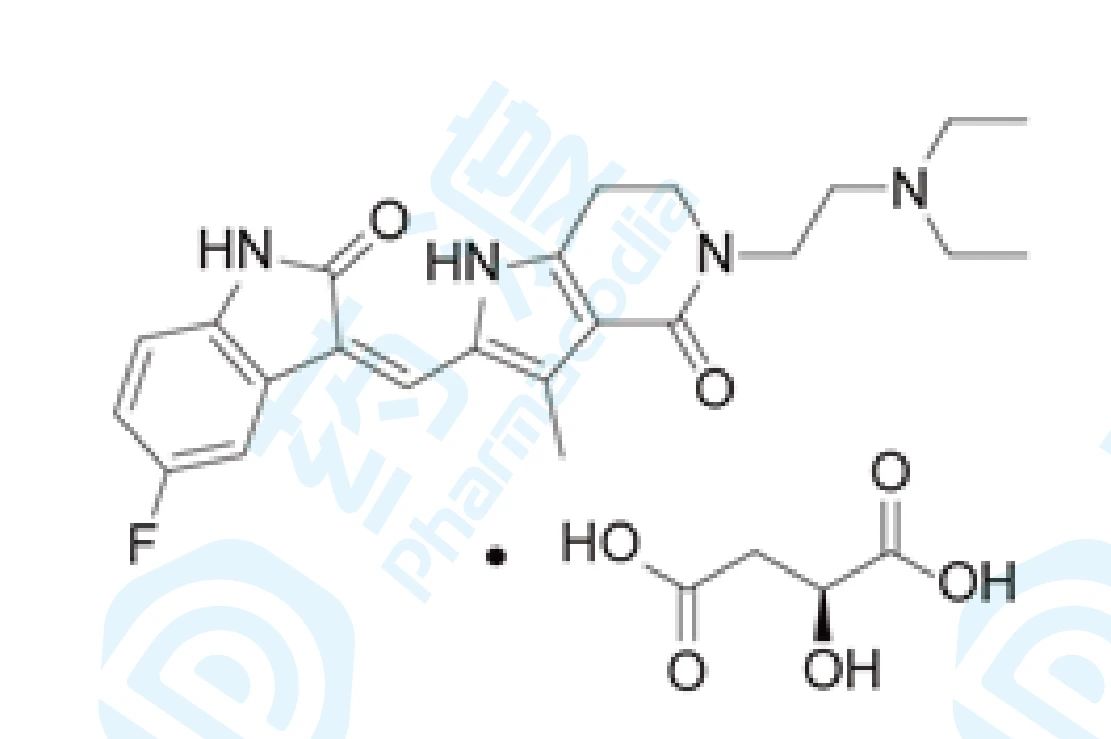
苹果酸法米替尼是恒瑞医药自主研发的一种小分子多靶点酪氨酸激酶抑制剂,可靶向并抑制c-Kit,VEGFR2,VEGFR3,PDGFR,Flt1和Flt3等激酶的活性。其处于治疗转移/复发结直肠癌和非小细胞肺癌的临床三期研究阶段,治疗宫颈癌、子宫内膜癌、输卵管癌、胃肠道间质瘤、鼻咽癌、神经内分泌肿瘤、卵巢癌、腹膜癌、肾细胞癌和泌尿生殖系统癌症的临床二期研究阶段和治疗骨肉瘤的临床一/二期研究阶段。对晚期非鳞、非小细胞肺癌(NSCLC)的临床III期研究,因患者招募困难而终止,此外对胃肠道间质瘤、晚期或转移性胃肠胰 腺神经内分泌瘤、乳腺癌等恶性肿瘤及特发性肺纤维化的研究也在进行中。
2020年1月恒瑞向国家药品监督管理局(NMPA)递交了多项临床试验申请(化药1类),并于3月获得临床试验默示许可,分别用于与注射用卡瑞利珠单抗联用治疗晚期泌尿系统肿瘤和妇科肿瘤以及联合注射用卡瑞利珠单抗治疗晚期实体瘤。
研发里程碑
2020年3月,该药的两个IND申请获得国家药品监督管理局(NMPA)承办,为化药一类。
2020年1月16日,该药的两个IND申请获得国家药品监督管理局(NMPA)承办,为化药一类。2020年3月,该药获得NMPA临床试验批件,适用于联合注射用卡瑞利珠单抗治疗晚期实体瘤。
2020年1月15日,该药的两个IND申请获得国家药品监督管理局(NMPA)承办,为化药一类。2020年3月,该药获得NMPA临床试验批件,与注射用卡瑞利珠单抗联用治疗晚期泌尿系统肿瘤及妇科肿瘤。
2016年6月,一项随机、双盲、平行分组的临床III期试验(NCT02766140、HR-FMTN-II / III-NSCLC-COM)在中国开始,以评估法米替尼联合多西他赛对患有局部晚期/转移/复发非鳞状NSCLC的患者(n = 574)的疗效和安全性。该研究因患者招募困难于2017年2月终止。
2015年1月,苹果酸法米替尼联合多西他赛治疗晚期非鳞、非小细胞肺癌患者(n=144)的非随机、开放式、单臂的临床II期研究(CTR20140851、HR-FMTN-II-NSCLC-COM-1)(第一阶段)在中国完成首例受试者入组,以确定DLT和MTD,及评估耐受性、安全性和PK参数及初步的疗效。
2015年3月,苹果酸法米替尼治疗晚期结直肠癌患者(n=540)的随机、双盲、安慰剂平行对照、多中心IIb/III期临床研究(CTR20150185、 HR-FMTN-IId / III-CRC)在中国完成首例受试者入组。至2018年4月,该研究仍处于患者招募中。
2015年1月,一项多中心、随机、双盲、安慰剂对照、平行分配的临床III期研究(NCT02390947、 HR-FMTN-CRC-FACT)开始,以在晚期结直肠癌患者(n=540)中评估法米替尼的安全性和有效性。该研究预计完成日期为2019年6月。
2014年11月,评估法米替尼联合多西他赛二线治疗EGFR野生型的非鳞状转移性NSCLC患者的安全性和有效性的临床Ib研究(NCT02364362)在中国开始。
2014年10月,苹果酸法米替尼治疗晚期非鳞、非小细胞肺癌随机、双盲、安慰剂平行对照、多中心II期临床试验(CTR20140850、HR-FMTN-II-NSCLC-MON)在中国完成首例受试者入组。
2012年5月,一项单机构、开放标签、单臂临床II期试验(NCT01653574、Fudan BR2012-10)在HER2阴性的转移性乳腺癌患者(n = 28)中启动,且于2013年11月完成。
2012年4月,对晚期结直肠癌患者(n = 150)的一项随机、双盲、安慰剂平行对照的多中心临床IIb期研究(NCT01762293、FMTN-IIb-CRC)在中国开展。该研究的第二阶段试验于2014年4月完成。于2015年ASCO胃肠癌会议发布的数据显示,法米替尼与安慰剂组的中位PFS分别为2.8个月和1.5个月,总体而言,famitinib耐受性良好、**可控。
2011年7月,在中国开展了一项非随机、开放标签的临床II期研究(NCT01392235、FMTN-II-NPC),用于评估法米替尼治疗转移性鼻咽癌患者(预计n = 58)安全性和有效性。该研究计划于2012年3月完成。于2013年6月第49届ASCO会议公布的数据显示,患者接受25mg qd法米替尼的治疗的临床受益率为32.8%。可观察到部分缓解和疾病稳定的患者分别为5名和16名,中位PFS为3.2个月。而至2014年4月,该研究的第二阶段试验已完成。
2008年6月,由江苏恒瑞医药股份有限公司向CFDA提交的临床试验申请(化药1.1)获CDE承办,且于2009年5月获批临床。
16 TQB3454片
TQB-3454由正大天晴研发并于2020年1月向国家药品监督管理局(NMPA)递交了临床试验申请(化药1类)。2020年3月获得临床试验默示许可,用于治疗晚期实体肿瘤和血液瘤。
17 索凡替尼胶囊
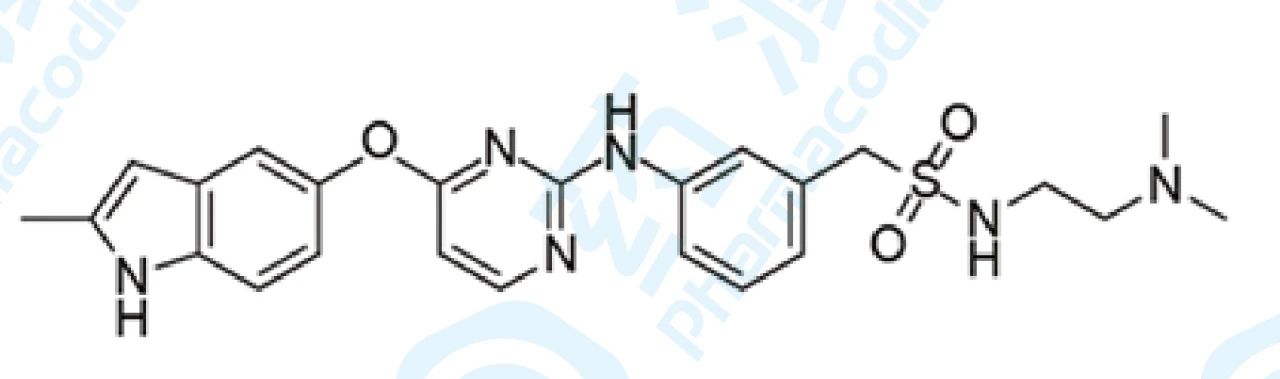
索凡替尼 (HMPL-012) 是由和记黄埔医药自主研发的口服新型血管免疫激酶抑制剂,选择性靶向血管内皮生长因子受体(VEGFR),成纤维细胞生长因子受体(FGFR)和集落刺激因子-1受体(CSF-1R)。索凡替尼对晚期非胰 腺来源神经内分泌瘤的研究处于临床三期,治疗胆道癌的研究处于临床二/三期,治疗甲状腺癌的临床二期,以及治疗实体瘤的临床一期试验。
2020年1月和记黄埔向国家药品监督管理局(NMPA)递交了临床试验申请(化药1类)。2020年3月获得临床试验默示许可,拟与信迪利单抗注射液联合用于晚期肝细胞癌、胆道癌、食管鳞癌、晚期胃及胃食管交界性腺癌、晚期结直肠腺癌、晚期三阴性乳腺癌患者。最终适应症的选择可能会根据Ib期临床研究的结果进行适当调整。
18 氟唑帕利胶囊
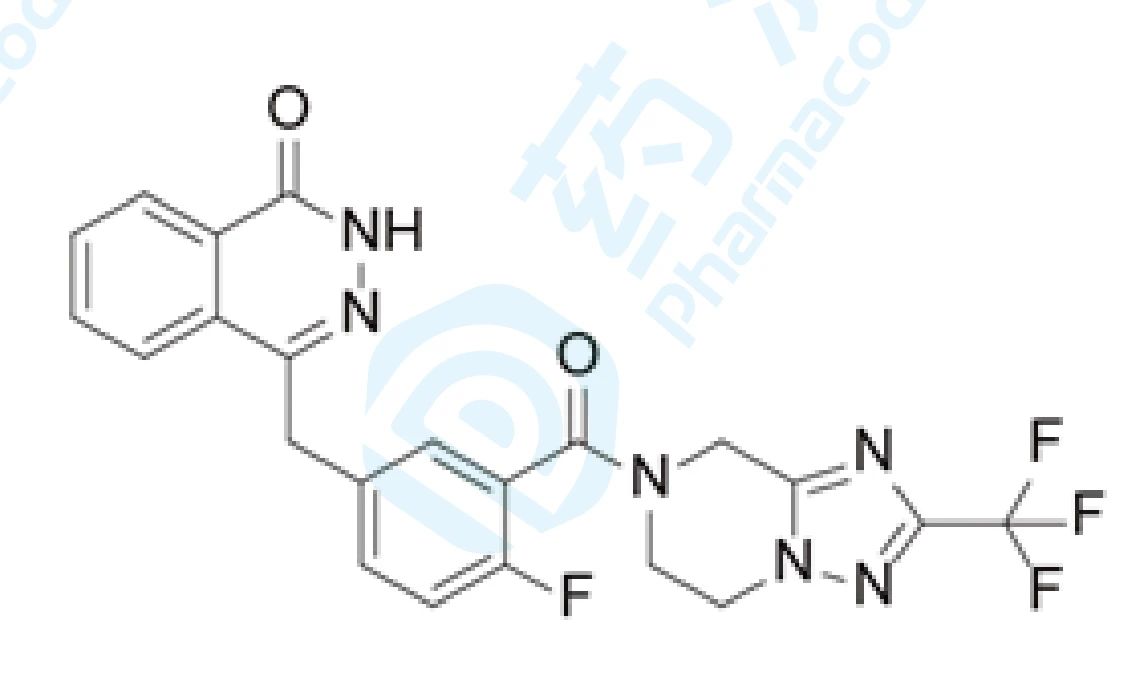
氟唑帕利是恒瑞医药和豪森医药研发的PARP1/2抑制剂,拟用于治疗复发性卵巢癌、三阴性乳腺癌、晚期胃癌、小细胞肺癌及其他晚期实体瘤。2020年1月恒瑞向国家药品监督管理局(NMPA)递交了临床试验申请(化药1类),并于2020年3月获得临床试验默示许可,用于联合mFOLFIRINOX化疗并序贯氟唑帕利胶囊单药维持治疗晚期胰 腺癌。
研发里程碑
2020年3月7日,该药的IND申请获得国家药品监督管理局(NMPA)承办,为化药一类。
2020年1月17日,该药的IND申请获得国家药品监督管理局(NMPA)承办,为化药一类。2020年3月,该药获得NMPA临床试验批件,拟用于联合mFOLFIRINOX化疗并序贯氟唑帕利胶囊单药维持治疗晚期胰 腺癌。
2019年12月,该药的2个IND申请获得中国国家药品监督管理局受理,并于2020年2月获得临床试验默示许可,氟唑帕利胶囊联合甲磺酸阿帕替尼片用于晚期上皮性卵巢癌、输卵管癌或原发性腹膜癌在含铂化疗达到完全缓解或部分缓解后的维持治疗,以及氟唑帕利胶囊或氟唑帕利胶囊联合甲磺酸阿帕替尼片治疗伴有BRCA1/2突变的HER2阴性转移性乳腺癌。
2019年12月,氟唑帕利联合SHR-1316治疗既往接受过一线含铂方案化疗且疾病进展的小细胞肺癌(SCLC)的临床申请获得CDE的临床默示许可。
2019年11月,该药的IND申请(化药一类)获得中国国家药品监督管理局受理,并于2020年1月获得临床试验默示许可,拟用于联合醋酸阿比特龙治疗既往未接受过新型雄激素受体(AR)靶向药物治疗的转移性去势抵抗性前列腺癌(mCRPC)。
2019年10月,该药的NDA申请获得国家药品监督管理局(NMPA)承办,适应症为复发性卵巢癌。
2019年4月,SHR3680联合氟唑帕利治疗去势抵抗性前列腺癌的II期临床研究(CTR20190608;CTR20190607)在中国开始招募患者,由恒瑞医药申办。
2019年2月,氟唑帕利胶囊对比安慰剂用于复发性卵巢癌维持治疗的随机、双盲、对照、多中心Ⅲ期临床研究(CTR20190294)已在中国开始,由恒瑞医药申办。
2019年1月,由恒瑞提交的中国1类临床申请获CDE受理,并于2019年3月获得临床默示许可。
2018年7月,由恒瑞医药提交的临床补充申请获CDE受理,后于2018年9月获得临床试验批件。
2018年4月,在BRCA1/2突变的复发性卵巢癌患者中进行的单臂、多中心Ⅰb期临床研究(CTR20180156、HR-FZPL-Ⅰb-OC)在中国开始,后同一方案对卵巢癌临床II期试验(NCT03509636、HR-FZPL-Ⅰb-OC)显示已在中国开始,由豪森医药申办。
2017年3月,氟唑帕利联合阿帕替尼治疗卵巢癌或三阴性乳腺癌的I期临床研究(CTR20170154)在中国开始,由豪森医药申办。
2017年2月,氟唑帕利联合阿帕替尼和紫杉醇治疗胃癌的 I 期临床研究(CTR20161033)在中国开始,由豪森医药申办。
2015年4月,氟唑帕利在晚期实体瘤患者中的耐受性及药代动力学I期临床研究(CTR20131369)在中国开始,并于2018年3月完成。
2012年12月,由豪森医药提交的IND申请(化药1.1类)获得CDE受理,并于2013年9月获得临床批件。
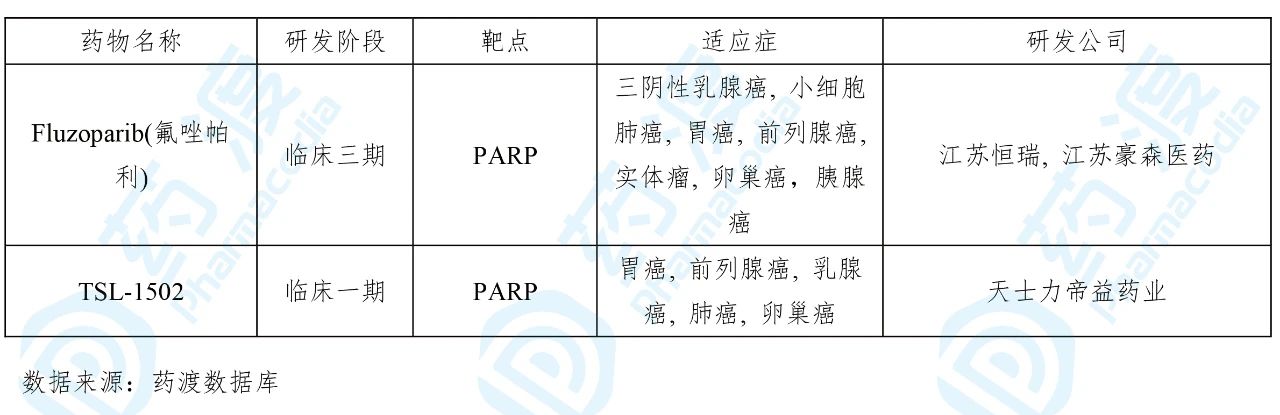
目前靶向PARP的中国1类药物如下表所示:
19 IN-10018片
IN-10018是由应世生物科技有限公司研发的粘着斑激酶(FAK)抑制剂。2020年1月应世生物向国家药品监督管理局(NMPA)递交了临床试验申请(化药1类),并于2020年3月获得临床试验默示许可,与PD1联合治疗晚期或转移性非小细胞肺癌。
1类生物药临床审批概况
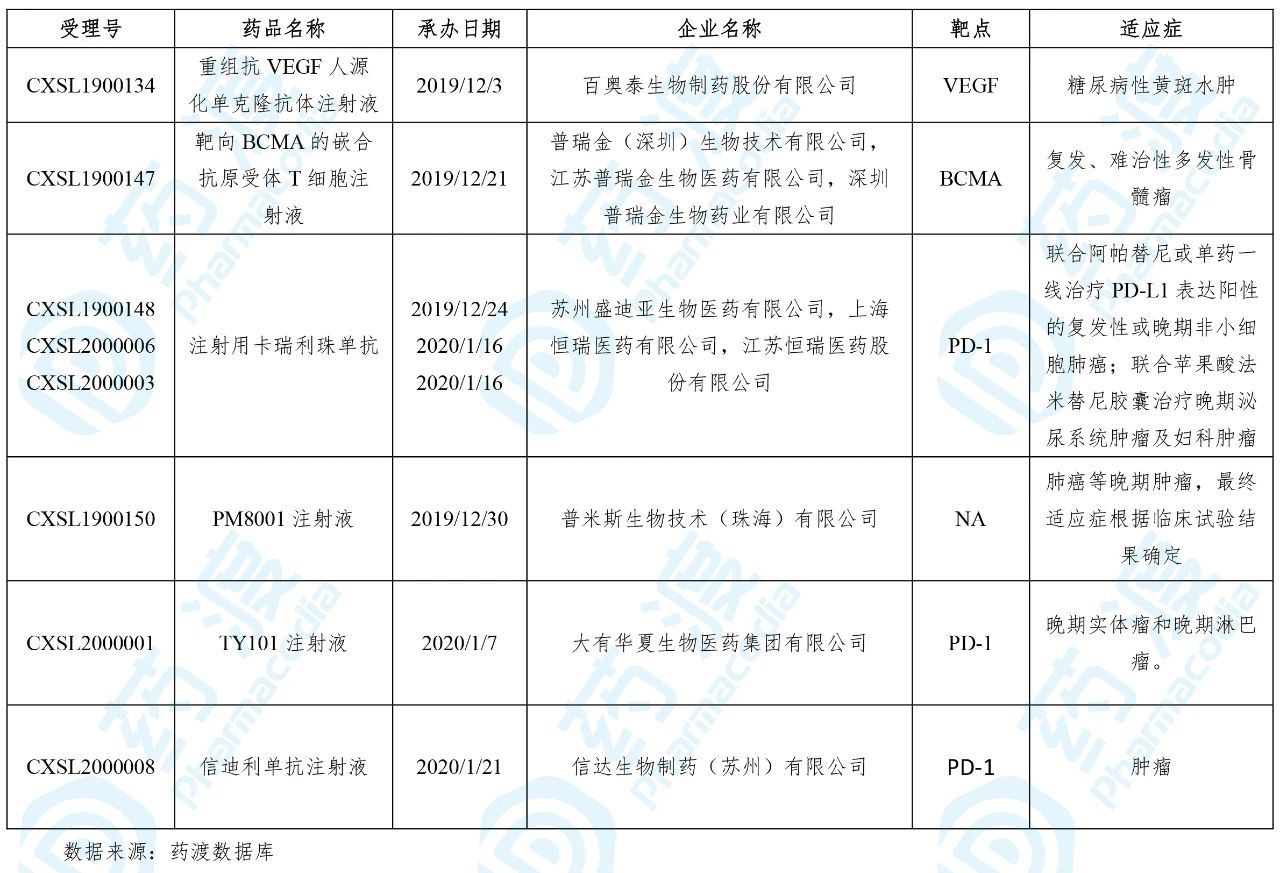
2020年3月,共有6个中国1类治疗用生物制品获得国家药品监督管理局(NMPA)的临床试验默示许可,具体信息如下表所示
01 重组抗VEGF人源化单克隆抗体注射液
百奥泰生物开发的重组抗VEGF人源化单克隆抗体,拟用于治疗眼部疾病。2019年12月百奥泰向国家药品监督管理局(NMPA)递交了临床试验申请(治疗用生物制品1类),并于2020年3月获得临床试验默示许可,用于治疗糖尿病性黄斑水肿(DME)。
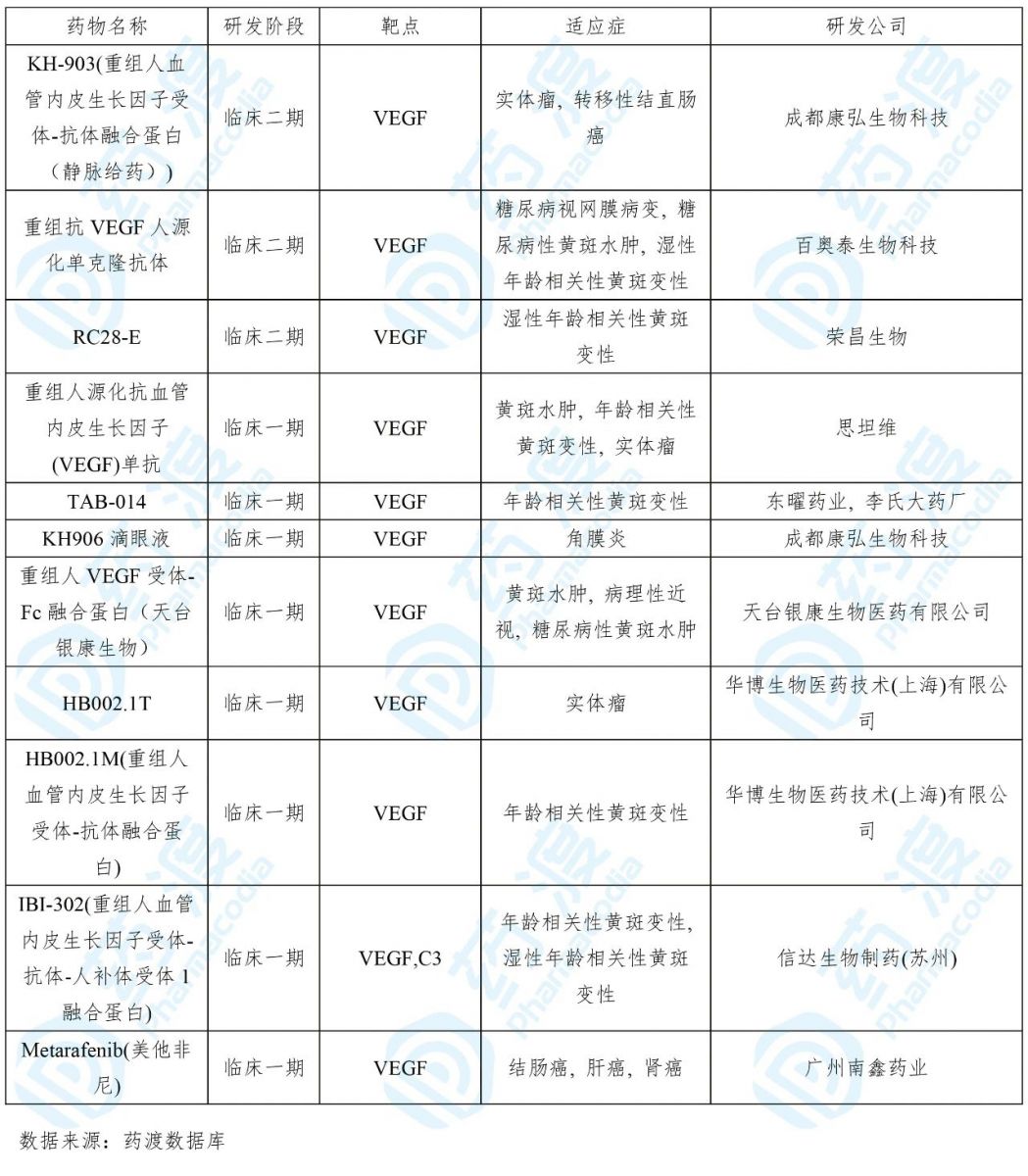
目前靶向VEGF的中国1类药物如下表所示:
02 靶向BCMA的嵌合抗原受体T细胞注射液
靶向BCMA的嵌合抗原受体T细胞由普瑞金生物研发并于2019年12月向国家药品监督管理局(NMPA)递交了临床试验申请(治疗用生物制品1类)。2020年3月获得临床试验默示许可,用于治疗复发、难治性多发性骨髓瘤。
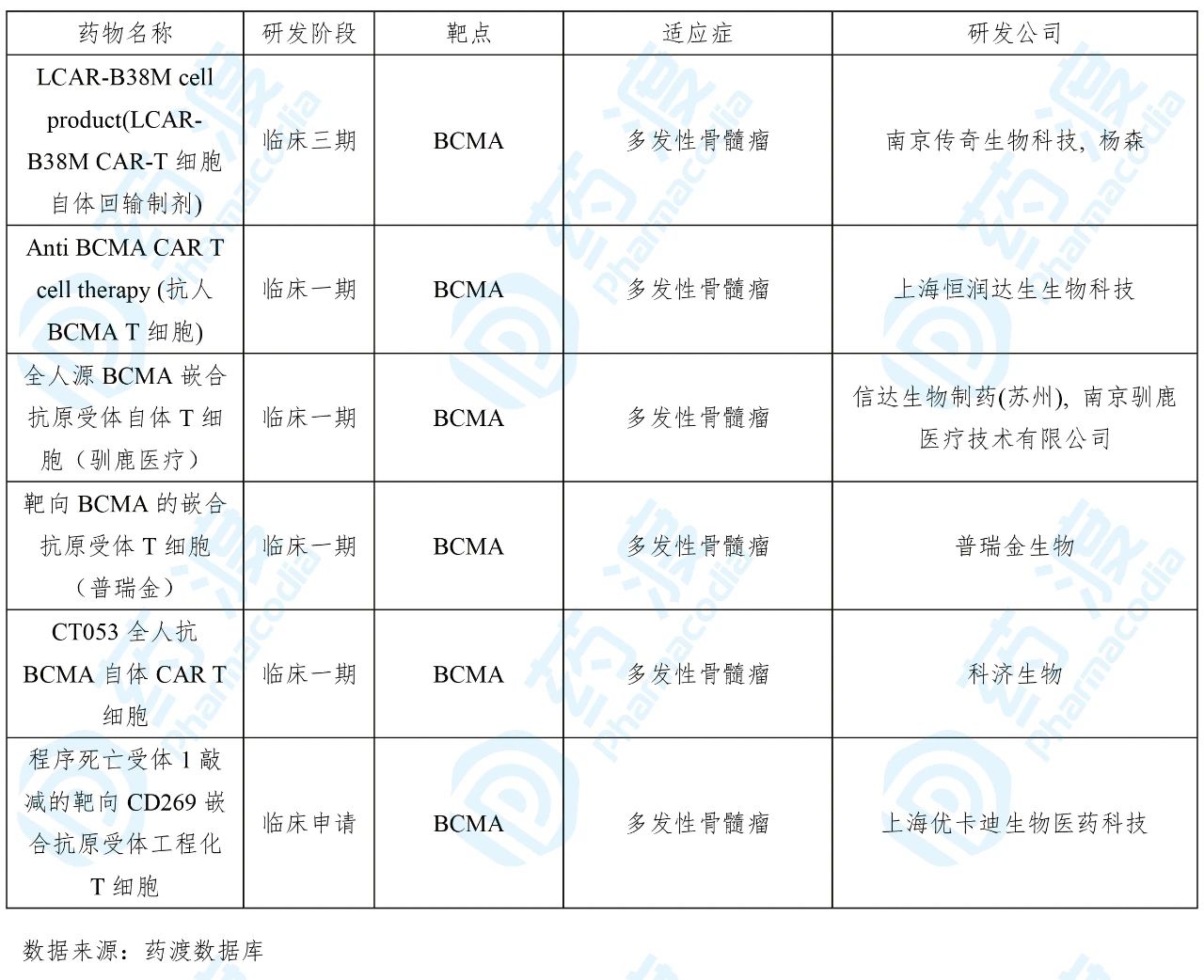
目前靶向BCMA的中国1类药物如下表所示:
03 注射用卡瑞利珠单抗
卡瑞利珠单抗(SHR-1210)是由江苏恒瑞研发的一种靶向于程序性细胞死亡因子1(PD-1)的人源化单克隆抗体,于2019年5月29日获国家药品监督管理局(NMPA)批准上市,商品名为艾瑞卡?,用于治疗既往接受过至少二线系统性治疗的复发/难治性经典型霍奇金淋巴瘤(cHL)患者。2020年3月获批用于治疗接受过索拉非尼治疗和/或含奥沙利铂系统化疗的晚期肝细胞癌患者。此外复发或转移性鼻咽癌、晚期食管癌、复发或难治性结外NK/T细胞淋巴瘤(鼻型)、非小细胞肺癌、晚期泌尿系统肿瘤、妇科肿瘤、软组织肉瘤、胃食管交界癌、转移性结直肠癌、小细胞肺癌等实体瘤的研究也在进行中。
2019年12月和2020年1月恒瑞向国家药品监督管理局(NMPA)递交了多项临床试验申请(治疗用生物制品1类),并于2020年3月获得临床试验默示许可,用于联合阿帕替尼或单药一线治疗PD-L1表达阳性的复发性或晚期非小细胞肺癌以及联合苹果酸法米替尼胶囊治疗晚期泌尿系统肿瘤及妇科肿瘤。
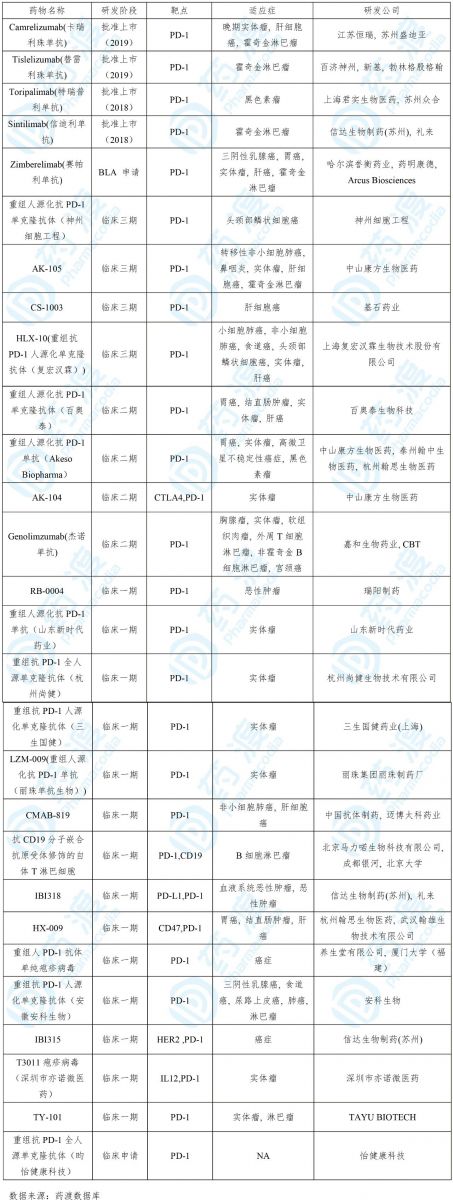
目前靶向PD-1的中国1类药物如下表所示:
04 PM8001注射液
PM-8001是由普米斯研发的一种双特异性抗体,由普米斯于2019年12月向国家药品监督管理局(NMPA)递交了临床试验申请(治疗用生物制品1类)。2020年3月获得临床试验默示许可,用于治疗肺癌等晚期肿瘤,最终适应症根据临床试验结果确定。
05 TY101注射液
TY-101是由大有生物研发的抗PD-1单克隆抗体,并于2020年1月由大有生物向国家药品监督管理局(NMPA)递交了临床试验申请(治疗用生物制品1类)。2020年3月获得临床试验默示许可,用于治疗晚期实体瘤和晚期淋巴瘤。
06 信迪利单抗注射液
信迪利单抗(IBI-308)是信达生物开发的一种全人源单克隆抗体,靶向于程序性死亡受体1(PD-1),通过阻断体内PD-1与配体PD-L1之间的结合,使T细胞发挥正常作用,进而利用自身免疫清除肿瘤细胞。信迪利单抗用于至少经过二线系统化疗的复发或难治性经典型霍奇金淋巴瘤的治疗于2018年12月24日获NMPA批准上市,商品名为达伯舒?(Tyvyt?),此外,治疗晚期或转移性鳞状非小细胞肺癌、胃及胃食管交界处腺癌的研究,现处于临床III期。2020年1月信达生物向国家药品监督管理局(NMPA)递交了临床试验申请(治疗用生物制品1类)。2020年3月获得临床试验默示许可,用于治疗肿瘤。
中国1类新药NDA申请概况
2020年3月,国家药品监督管理局(NMPA)药审中心共承办了1个中国1类新药的NDA申请,具体信息如下表所示:
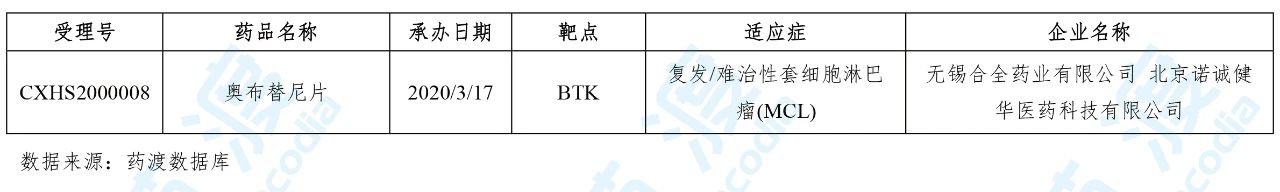
01 奥布替尼片
奥布替尼是诺诚健华医药研发的BTK抑制剂,目前其用于治疗慢性淋巴细胞白血病(CLL)、小淋巴细胞淋巴瘤(SLL)和套细胞淋巴瘤(MCL)的新药上市申请(NDA)已被中国国家药品监督管理局(NMPA)受理。此外,本品也正在进行治疗类风湿性关节炎(RA)和系统性红斑狼疮(SLE)的一期临床研究以及联合重组人源化II型CD20单克隆抗体MIL62注射液治疗复发/难治CD20+B细胞淋巴瘤的一期临床研究。同时,本品还拟用于治疗复发难治性边缘区淋巴瘤(MZL)和华氏巨球蛋白血症等。
研发里程碑
2020年3月,该药治疗复发/难治性套细胞淋巴瘤的上市申请获得NMPA受理。
2020年1月2日,该药用于治疗慢性淋巴细胞白血病(CLL)和小淋巴细胞淋巴瘤(SLL)的上市申请被CDE纳入优先审评程序。
2019年11月20日,诺诚健华宣布,中国国家药品监督管理局(NMPA)已受理奥布替尼(ICP-022)用于治疗复发/难治慢性淋巴细胞白血病(CLL)/小淋巴细胞淋巴瘤(SLL)患者的新药上市申请(NDA)。
2019年5月,在美国的IND通过FDA审评。
2019年2月,评价ICP-022治疗复发或难治华氏巨球蛋白血症的临床II期试验(CTR20190364)拟在中国开始。
2019年1月,一项对复发难治边缘区淋巴瘤的II期临床研究计划2019年2月在中国开始。
2018年4月,对复发/难治性CLL或者SLL患者的临床I/II期试验(NCT03493217、CTR20180263、ICP-CL-00103)在中国开始,预计将于2020年12月完成。
2018年2月,一项评价ICP-022 治疗复发或难治性套细胞淋巴瘤安全性和有效性的多中心、开放性的临床I/II试验(NCT03494179、ICP-CL-00102、CTR20180196)在中国开始,预计将于2020年12月完成。
2017年7月,一项随机、双盲、安慰剂对照的单中心剂量递增临床I期试验(NCT03189017)在澳大利亚RA和SLE患者中启动,于2017年12月公开消息显示,ICP-022在该研究中显示了良好的安全性和药代药效动力学特性,对治疗类风湿关节炎和系统性红斑狼疮具有良好前景。
2017年6月12日,北京诺诚健华医药科技有限公司首次向中国食品药品监督管理总局(CFDA)提交临床试验申请(化药1类),并于2018年12月19日,获得CFDA批准开展针对系统性红斑狼疮(SLE)和类风湿关节炎(RA)的临床试验。
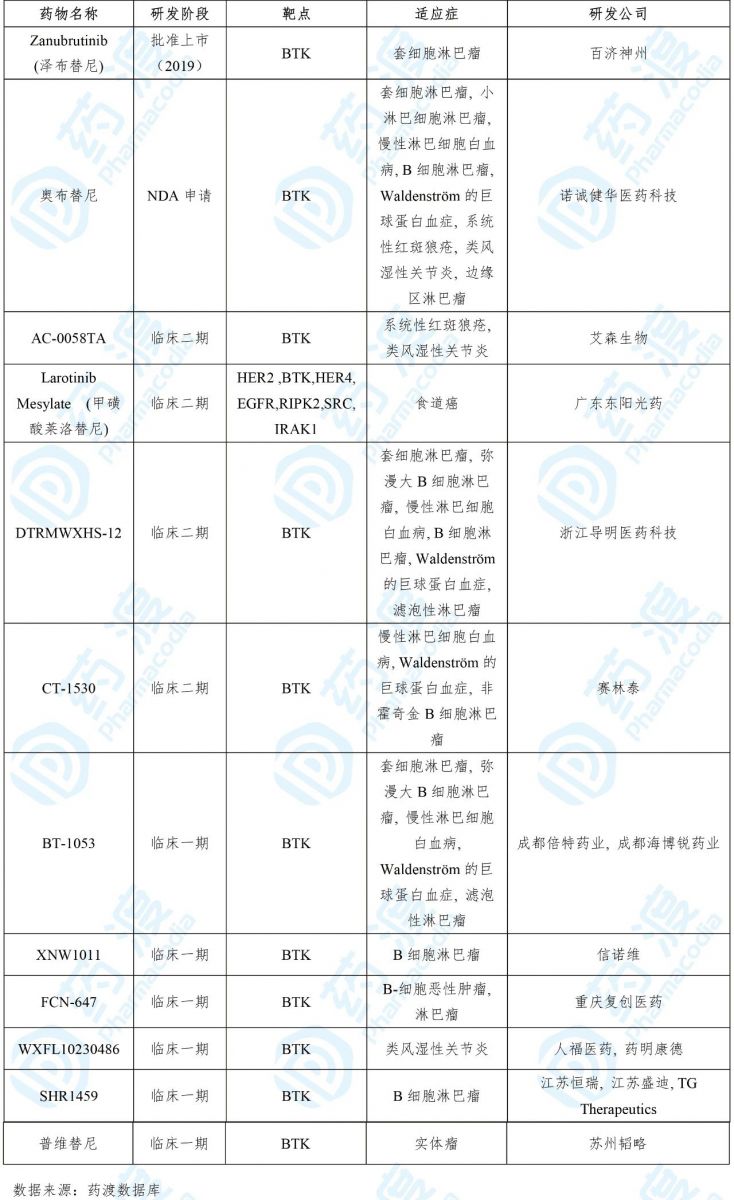
目前靶向BTK的中国1类药物如下表所示:



合作咨询
![]() 肖女士
肖女士
![]() 021-33392297
021-33392297
![]() Kelly.Xiao@imsinoexpo.com
Kelly.Xiao@imsinoexpo.com
 2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57
2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57