https://www.cphi.cn 2020-05-06 10:01 来源:CPhI制药在线 作者:1°C
五月 (May)是公历第五个月,是以一位名叫迈亚(Maia)的女神命名的,象征着着"生长"和"春日",希望新型冠状病毒早日离去,祈福安康。2020年的05月,FDA将有3项备受关注的注册审评揭晓答案,笔者在这里带大家提前关注这3项进展。
进展一:PARPi将首次收获前列腺癌新适应症
2019年11月,Clovis Oncology递交Rubraca一项补充上市申请,适应症为BRCA1/2-突变去势抵抗前列腺癌三线治疗,TRITON2 (NCT02952534) 是支持此次上市申请的关键临床数据,PDUFA日期05月15日。
这项注册审评具有重要意义,这将是PARPi首次将适应症拓展至去势抵抗前列腺癌,ESMO 2019最新数据显示,Rubraca能够给BRCA1/2-突变去势抵抗前列腺癌患者带来明显临床获益,ORR, 43.9% (25/57), 其中3例患者达到完全缓解。

ESMO 2019
去势抵抗前列腺癌:ORR, 43.9% (25/57)
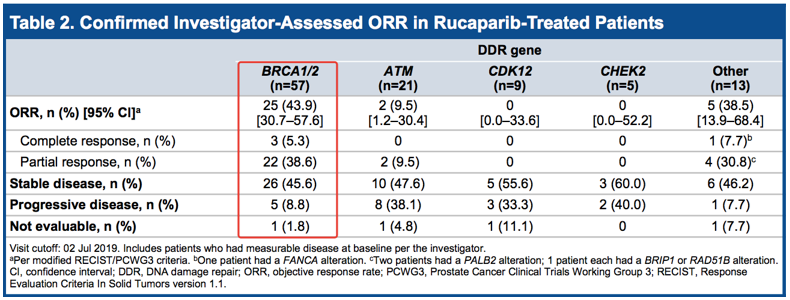
ESMO 2019, https://clovisoncology.com/media/1160/esmo2019_wabida_poster.pdf
截至目前,PARP抑制剂已经拓展了3个适应症,分别是卵巢癌、乳腺癌、胰 腺癌,此次,Rubraca将会领先利普卓率先收获第4个适应症-去势抵抗前列腺癌。
2019年,PARP抑制剂中的利普卓全球市场销售额首次超过10亿美元。
PARP抑制剂有几个值得关注的地方:
o Lynparza (olaparib) 率先将PARP抑制剂拓展至BRCA+/HER2-乳腺癌患者,Talzenna (talazoparib) 则是第2个获批乳腺癌适应症的PARPi;
o 卵巢癌一线适应症的PARP抑制剂目前只有Lynparza (olaparib) 一个,不久的未来,会有更多;
o Zejula (niraparib) 则率先将卵巢癌从BRCA拓展至其他HRD,这种情况会越来越常见;
o Zejula (niraparib) 则率先将卵巢癌从BRCA拓展至不限定HRD的适应症,临床数据可参考DOI: 10.1056/NEJMoa1910962;
当然,2020年01月,利普卓业已向FDA递交去势抵抗前列腺癌二线治疗的上市申请,并获得优先审评资格,PDUFA日期2020年2季度 (极有可能是今年6月份),PROfound(NCT02987543)数据显示,利普卓能够给BRCA1/2或ATM突变去势抵抗前列腺癌二线治疗患者带来总生存期获益,但是尚未公布详细数据。
进展二:Opdivo+Yervoy收获首个非小细胞肺癌一线适应症
相比可瑞达在非小细胞肺癌一线适应症顺风顺水得拓展,欧狄沃在非小细胞肺癌一线的拓展则不算顺利,Opdivo+Yervoy 曾计划凭借CheckMate -227 获批用于TMB≥10 mutations/megabase 非小细胞肺癌患者,但是,该适应症上市申请先后被百时美施贵宝撤回。
2020年01月15日,百时美施贵宝又一次凭借CheckMate -227 part 1a数据,申请用于PD-L1阳非小细胞肺癌一线治疗患者,Opdivo + Yervoy vs. 化疗可给PD-L1阳非小细胞肺癌患者带来显著总生存期获益,2 year OS 40% vs. 33%
PDUFA日期05月15日,这是一个值得关注的进展,如若顺利,这将是首个获批用于非小细胞肺癌一线治疗的双免疫检查点抑制剂联合用药。
值得注意的是,Opdivo + Yervoy联合化疗也向FDA递交了上市申请,CheckMate-9LA (NCT03215706) 是此次上市申请的注册临床数据,PDUFA日期08月06日,敬请关注。
进展三:Dupixent将在美国收获第5个适应症
Dupixent (dupilumab) 是一款靶向于IL-4Rα的全人单克隆抗体,作用于2型免疫关键通路,潜在适应症包括IL-4, IL-5, IL-13介导的2型免疫适应症。Dupilumab是Regeneron 和Sanofi合作产生的最耀眼的结晶。
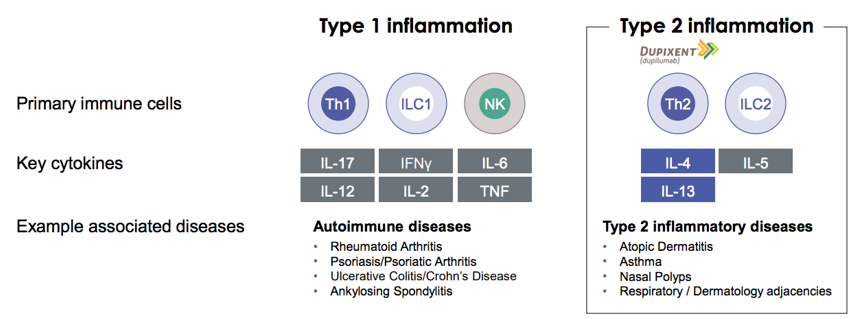
Dupixent: 已收获特应性皮炎、哮喘、慢性鼻-鼻窦炎伴鼻息肉3个适应症
Dupixent (dupilumab)未来将在皮肤、呼吸、鼻息肉等多个2型免疫适应症拓展。
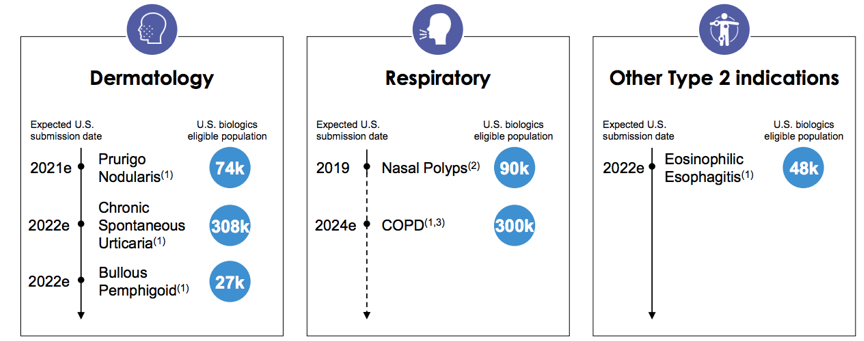
Dupilumab在美国获批适应症总结:
o 2020年05月28日,Dupilumab预计获批用于6 - 11岁中重度特应性皮炎患者,注册临床试验为NCT03345914;
o 2019年06月26日,Dupilumab获批用于成人慢性鼻-鼻窦炎伴鼻息肉,注册临床试验24-周SINUS-24 和 52-周SINUS-52;
o 2019年03月11日,Dupilumab获批用于12 -17 岁中重度特应性皮炎患者,注册临床试验NCT03054428;
o 2018年10月19日,Dupilumab获批用于12岁及以上中重度哮喘,注册临床试验NCT02414854,NCT02528214;
o 2017年03月28日,Dupilumab获批用于成人中重度特应性皮炎患者,注册临床试验NCT02277743, NCT02277769, NCT2260986。
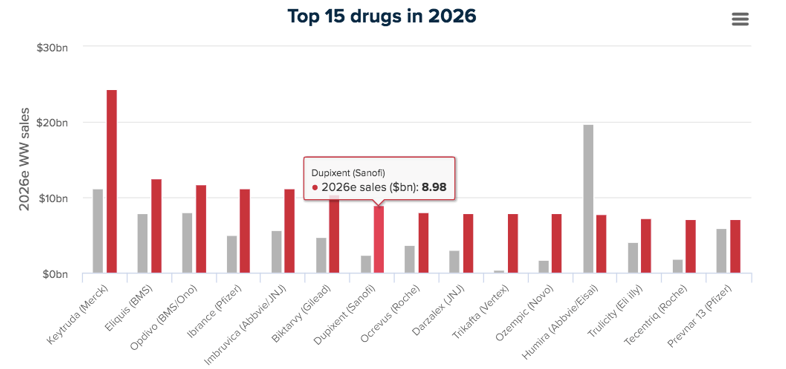
2020年05月28日,这将是Dupilumab在特应性皮炎适应症上的第3次拓展,未来6年,Dupilumab市场增长预计十分积极,2019年销售额23.2亿美元,2026年预计为89.8亿美元,年复合增长率21.3%
作者简介:1°C,医药行业从业人员,希望自己的专业文字会越来越有温度,医药知识能够服务更多人,打破信息知识的壁垒!
点击下图进行CPhI & P-MEC China 2020观众预登记!立省100元门票
版权所有,未经允许,不得转载。
投稿合作联系方式: Kelly.Xiao@imsinoexpo.com 021-33392297
地址:上海市徐汇区虹桥路355号城开国际大厦7-8楼 200030