日前,今年第三场FDA肿瘤药物咨询委员会(ODAC)会议尘埃落定。此次ODAC会议就2022年8月受理的阿斯利康的PARP抑制剂——奥拉帕利的新适应症申请(联合阿比特龙和泼尼松或泼尼松龙治疗转移性去势抵抗性前列腺癌)展开讨论。
最终,专家组以11票赞同,1票反对,1票弃权的结果,认为奥拉帕利联合阿比特龙和泼尼松或泼尼松龙治疗转移性去势抵抗性前列腺癌(mCRPC)患者初始治疗的适应症应严格限制在肿瘤伴BRCA突变的患者中。
这意味着,奥拉帕利闯关晚期前列腺癌一线治疗不限HRR状态(同源重组修复,包括BRCA1/2、ATM等)适应症的失败。事实上,对于PARP抑制剂来说,这已经不是首次失败。去年,已获批上市的几款PARP抑制剂甚至撤销适应症。那么对于PARP抑制剂来说,未来研发方向在哪?
合成致死靶点:PARP
PARP(Poly ADP-ribosepolymerase)全称为多聚腺苷二磷酸核糖聚合酶,是一种DNA修复酶,在DNA损伤修复、维持基因组稳定性方面起着重要作用。
PARP家族共有17个成员,其中PARP1是PARP家族中最主要的成员,其在细胞中承担着PARP家族90%以上的功能,是DNA损伤修复中的关键作用因子。
PARP通过与DNA损伤位点相结合并且催化多聚ADP核糖链在蛋白底物上的合成,通过募集DNA修复蛋白到损伤位点共同修复DNA损伤。
PARP抑制剂是第一种成功利用合成致死概念获得批准上市的抗癌疗法。所谓“合成致死”即指当两个非致死性突变基因单独发生时不会导致细胞死亡,而同时发生时可引起细胞死亡的现象。
通常来说,细胞的损伤修复分为DNA单链损伤修复和DNA双链断裂修复。其中DNA单链损伤修复依赖于PARP介导的修复通路,而PARP抑制剂能够“诱捕”PARP(DNA单链断裂主要的修复途径),使其无法正常修复单链断裂的DNA。
而DNA的双链修复依赖HRR通路,肿瘤细胞中BRCA突变等HRR基因突变的患者,导致DNA双链断裂修复机制缺失,此时肿瘤细胞的单链和双链修复均无法进行,达到“合成致死”。
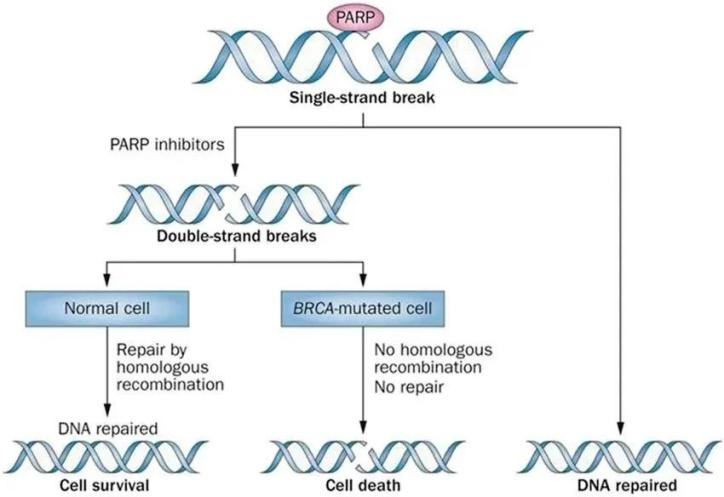
PARP抑制剂作用机理
图片来源:Nat Rev Clin Oncol. 2015 Jan;12(1):27-41
由于安全性风险
适应症连遭FDA多次撤回
自2014年奥拉帕利(olaparib)问世以来,全球已上市六款PARP抑制剂,分别是奥拉帕利、鲁卡帕利(Rucaparib)、尼拉帕利(Niraparib)、他拉唑帕利(Talazoparib)、氟唑帕利和帕米帕利。其中NMPA批准上市的有4款,分别是:奥拉帕利、尼拉帕利、氟唑帕利和帕米帕利。
然而随着临床试验随访时间的延长,数据显示,鲁卡帕利、奥拉帕利、尼拉帕利会使卵巢癌患者的死亡风险增加,因此,2022年,FDA连续撤回了这三款PARP抑制剂在卵巢癌的4个适应症。
具体来说,2022年6月,FDA撤回鲁卡帕利后线治疗BRCA突变晚期卵巢癌患者,这些患者既往接受过二线或二线以上的化疗。
2022年8月,FDA撤回奥拉帕利后线治疗BRCA突变晚期卵巢癌患者,这些患者既往接受过三线或三线以上的化疗。
2022年9月,FDA撤回尼拉帕利后线治疗BRCA突变、HRD阳性且铂敏感复发性上皮性卵巢癌、输卵管癌或原发性腹膜癌成人患者,这些患者既往接受过三线或三线以上的化疗。
2022年11月,FDA撤回尼拉帕利维持治疗铂敏感复发卵巢癌的部分适应症。最终仅保留用于有害或疑似有害的生殖系BRCA突变(gBRCAm)的卵巢癌患者的维持治疗。
PARP抑制剂路在何方?
为了克服PARP抑制剂耐药性及剂量依赖性毒 性的问题,研究者们开发了许多新策略,如下一代高选择性抑制剂以及双靶点抑制剂等。
在下一代高选择性抑制剂方面,阿斯利康研发了PARP1抑制剂——AZD5305。与已上市的 PARP1/2 抑制剂奥拉帕利不同,AZD5305对PARP1亚型具有高选择性,有望克服奥拉帕利的副作用。这是因为,PARP抑制剂的部分不良反应来源于其对PARP2的抑制,而PARP2 并非疗效所须。因此,阿斯利康研发了选择性抑制剂 AZD5305。
据临床前数据显示,AZD5305在具备显著PARP1-DNA 捕获活性的同时无 PARP2活性,也不结合PARP家族其他任何成员。
而且AZD5305仅在BRCA突变细胞中造成DNA损伤积累,而对BRCA野生型细胞无害。
在动物实验中,AZD5305 0.1 mg/kg剂量的抗肿瘤活性与奥拉帕利100 mg/kg剂量相当,且其抗肿瘤活性在停止用药后仍能持续存在。
此外,基于AZD5305对PARP1捕获的高度特异性,大鼠模型中未发现其会导致血液学毒 性。
因此,AZD5305有望成为较其他 PARP抑制剂具有更强疗效和安全性的下一代PARP抑制剂。
在双靶点抑制剂研发方面,研究人员开发了可同时靶向PARP和PI3K的双重抑制剂,在异种移植小鼠模型中,与单独给药奥拉帕利或PI3K抑制剂和联合使用奥拉帕利和PI3K抑制剂相比,双重抑制剂抗肿瘤疗效更为显著。
来自Rakovina Therapeutics公司的研发人员还开发了一款PARP/HDAC双重抑制剂kt-3283,在尤文氏肉瘤模型中,研究显示,kt-3283的疗效优于单剂PARP或HDAC抑制剂。
数据表明kt-3283在尤文氏肉瘤模型中的双重活性是FDA批准的PARP抑制剂的30- 80倍,是FDA批准的HDAC抑制剂的30- 60倍。
小 结
近年来,合成致死已成为肿瘤治疗领域的研究热点之一,PARP抑制剂作为首 个利用合成致死概念在临床上取得成功的药物,其在肿瘤尤其是卵巢癌治疗中展现了前所未有的获益。
尽管如此,但其耐药和毒副作用问题仍需进一步研究和解决。后来者如何基于PARP家族成员间结构的差异来设计并合成具有高度亚型选择性的小分子PARP抑制剂,或者开发双靶点抑制剂等,是目前该领域开发人员面临的主要问题。
相信随着药物设计体系的完善和技术的不断发展,未来很快会取得突破性成果。
参考:
1. The multifaceted roles of PARP1 in DNA repair and chromatin remodelling. Nat. Rev. Mol. Cell Biol. 2017, 18, 610–621.
2. 彭磊, 蒙春杨, 李云祥,等. PARP抑制剂治疗去势抵抗性前列腺癌的研究进展[J]. 现代肿瘤医学, 2022(013):030.
3. Rakovina Therapeutics Announces Publication Highlighting Activity of Novel Bi-functional PARP-HDAC Inhibitor in Preclinical Models of Ewing Sarcoma.



合作咨询
![]() 肖女士
肖女士
![]() 021-33392297
021-33392297
![]() Kelly.Xiao@imsinoexpo.com
Kelly.Xiao@imsinoexpo.com
 2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57
2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57