https://www.cphi.cn 2018-11-23 11:18 来源:药智网 作者:药小慧
三、药品上市许可持有人制度(MAH)的实施
(一)MAH制度工作的试点
2015年8月18日,国务院发布《关于改革药品医疗器械审评审批制度的意见》(国发〔2015〕44号),《意见》提出开展药品上市许可持有人制度试点。允许药品研发机构和科研人员申请注册新药,在转让给企业生产时,只进行生产企业现场工艺核查和产品检验,不再重复进行药品技术审评。试点工作在依照法定程序取得授权后开展。
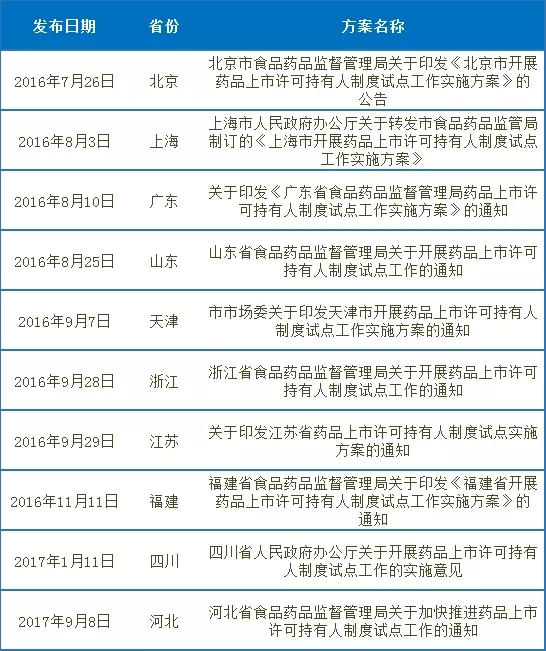
2016年6月6日,国务院办公厅发布《关于印发药品上市许可持有人制度试点方案的通知》(国办发〔2016〕41号),根据《全国人民代表大会常务委员会关于授权国务院在部分地方开展药品上市许可持有人制度试点和有关问题的决定》,在北京、天津、河北、上海、江苏、浙江、福建、山东、广东、四川等10个省(市)开展药品上市许可持有人制度试点。实施至2018年11月4日。标志着我国药品上市许可持有人制度开始建立。
2017年10月8日,中共中央办公厅、国务院办公厅印发《关于深化审评审批制度改革鼓励药品医疗器械创新的意见》:
(二十二)推动上市许可持有人制度全面实施。及时总结药品上市许可持有人制度试点经验,推动修订药品管理法,力争早日在全国推开。允许医疗器械研发机构和科研人员申请医疗器械上市许可。
(二十三)落实上市许可持有人法律责任。药品上市许可持有人须对药品临床前研究、临床试验、生产制造、销售配送、不良反应报告等承担全部法律责任,确保提交的研究资料和临床试验数据真实、完整、可追溯,确保生产工艺与批准工艺一致且生产过程持续合规,确保销售的各批次药品与申报样品质量一致,确保对上市药品进行持续研究,及时报告发生的不良反应,评估风险情况,并提出改进措施。
医疗器械上市许可持有人须对医疗器械设计开发、临床试验、生产制造、销售配送、不良事件报告等承担全部法律责任,确保提交的研究资料和临床试验数据真实、完整、可追溯,确保对上市医疗器械进行持续研究,及时报告发生的不良事件,评估风险情况,并提出改进措施。
受药品医疗器械上市许可持有人委托进行研发、临床试验、生产制造、销售配送的企业、机构和个人,须承担法律法规规定的责任和协议约定的责任。
(二十四)建立上市许可持有人直接报告不良反应和不良事件制度。上市许可持有人承担不良反应和不良事件报告的主体责任,隐瞒不报或逾期报告的,依法从严惩处。食品药品监管部门应对报告的不良反应和不良事件进行调查分析,视情责令上市许可持有人采取暂停销售、召回、完善质量控制等措施。
药品上市许可持有人制度(MAH)的核心内容是药品批准文号和生产许可脱离,允许试点的药品研发机构和科研人员取得药品的批准文号,并且对药品质量承担相应的责任。MAH出台之前,我们国家实行的是上市许可和生产许可统一捆绑的管理模式,只有生产企业才可以申请药品注册,取得最终的药品批准文号。这种药品注册与生产许可“捆绑”的模式,不利于鼓励创新,不利于保障药品供应,不利于抑制低水平重复建设。开展药品上市许可持有人制度试点工作,对于鼓励药品创新、提升药品质量具有重要意义。
表1-2-6 各省市药品上市许可持有人制度实施进度
(二)MAH制度取得的阶段性成效
国家食品药品监督管理总局统计了截至2016年12月25日各试点省份药品上市许可持有人试点品种申报情况,如下表所示。
表1-2-7 药品上市许可持有人试点品种申报情况表(截至2016年12月25日)

2016年12月23日,由山东省齐鲁制药有限公司研发的抗肿瘤新药吉非替尼及片剂经国家食品药品监管总局批准取得持有人文号,成为我国首个药品上市许可持有人制度试点品种。
2017年3月27日,浙江医药股份有限公司新昌制药厂的苹果酸奈诺沙星原料药及其胶囊剂经国家食品药品监管总局批准取得了药品上市许可持有人制度试点品种,浙江医药股份有限公司新昌制药厂为本品上市许可持有人。这是我国实施药品上市许可持有人制度试点工作以来,获批的首个创新药
2017年8月,浙江康德药业集团股份有限公司申报的丹龙口服液经国家食品药品监管总局批准取得了新药生产批件,同时该公司获得药品上市许可持有人。这是我国实施药品上市许可持有人制度试点工作以来,发放的首个中药新药上市许可持有人文号。标志着中药新药的上市许可持有人制度试点工作迈出了可喜的一步。
2018年6月,上海安必生制药技术有限公司成为国内首家获得上市许可持有人文号的药品研发机构。2016年9月,安必生以MAH申请人身份向国家食品药品监督管理局提交了孟鲁司特钠咀嚼片和普通片的上市申请。这两个品种是上海市食品药品监督管理局公布的首批参加MAH试点品种。安必生将其委托给杭州民生滨江制药有限公司生产。
未完待续……
如果这篇文章侵犯了您的权利,请联系我们。
投稿合作联系方式: Kelly.Xiao@imsinoexpo.com 021-33392297
地址:上海市徐汇区虹桥路355号城开国际大厦7-8楼 200030