对于创新药或者改良型新药,如果要想获得各国药政机构的批准,一般需要开展各类试验,证明自己具备安全性、有效性和质量可控性。因此说,临床试验在药品研发领域具有关键影响,是很多重磅药品取得上市许可的关键基石。因此,各国药政机构针对临床试验也发布了很多法规和指南,持续强化对临床试验的监管。
临床试验注册制度是指临床试验实施前就在公共数据库公开试验设计信息,并跟踪和报告试验结果。现在临床试验注册制度已成为当前临床试验发展的主流趋势。目前,国际上有很多临床试验注册平台,例如常用的如ClinicalTrials.gov、WHO International Clinical Trials RegistryPlatform(ICTRP)等,ClinicalTrials.gov因其注册流程简便,符合国际医学期刊编辑委员会(ICMJE)标准,是当前最 具国际影响力,应用最为广泛的临床试验注册机构之一。
ClinicalTrials.gov是由美国国立医学图书馆(NML)与美国FDA在1997年开发,于2002年2月正式运行的数据库。该数据库是一个开放的临床试验资料库,收录了全球由国家拨款或私募经费资助的各项试验目录,目前该数据库共登记了 223 个国家/地区的 484,161 项研究。其主旨有二:①向医疗卫生人员、患者和社会大众提供临床试验的查询服务;②向机构和医学科研人员提供临床试验的注册服务(图1)。
图1 ClinicalTrials.gov官网
临床试验信息的透明度对科学进步至关重要,对某些试验进行登记并公布总结结果信息,能够使科学界在现有信息的基础上进一步探讨科学研究项目。公众参与临床试验使进一步推进科学进步成为可能。美国联邦法律要求临床试验责任方在ClinicalTrials.gov数据库中注册并向其提交某些适用临床试验的结果信息。美国FDA将监督其合规性,并对未能向ClinicalTrials.gov提交所需临床试验信息的行为采取适当的执法行动。
首先,FDA可能会发布不符合初步通知函(预通知),以此来告知责任方可能不符合联邦法律规定注册和向ClinicalTrials.gov提交结果信息的法律要求。截止至2023年年底,FDA共发布了131条不符合预通知。预通知的内容可能包括:未能注册适用的临床试验、未能提交适用临床试验所需的临床试验信息、提交虚假或误导性的临床试验信息等(图2)。
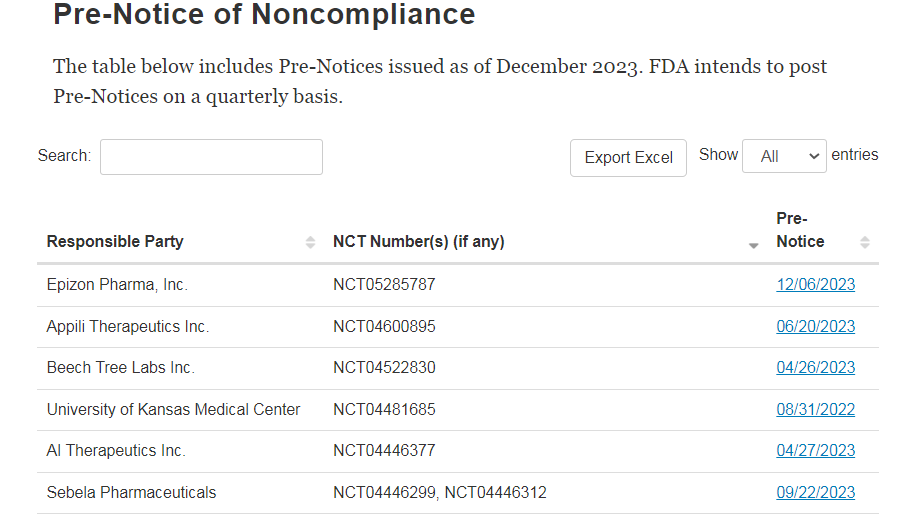
图2 FDA发布的有关ClinicalTrials.gov的不符合预通知(截图)
不符合预通知实际上就是给责任方一个主动整改的机会,它会预先通知要求责任方在收到信件后30天内解决任何不符合要求的问题。责任方收到预先通知后,FDA将进一步审查和评估临床试验记录以及其他相关信息,以确定责任方是否未能向ClinicalTrials.gov数据库提交所需的临床试验信息。如果FDA认定责任方未遵守法律要求,FDA将发出不符合通知。FDA可能会考虑在不采取进一步行动的情况下解决某些潜在不合规的情况(例如,当责任方是一家已倒闭的公司时),在这种情况下,FDA可能决定以行政方式结案。
2020年8月14日,FDA发布了《有关ClinicalTrials.gov数据库的民事处罚》的定稿指南。指南中详细描述了FDA各中心(包括药品、生物制品和器械中心)如何应对违反联邦法规要求,未能准确、完整地登记注册临床试验并在ClinicalTrials.gov网站上报告结果的责任方的问题。通常情况下,在FDA的生物研究监测谋划(BIMO)中获得的证据将作为识别违规者的依据,但监管行动也可能是由投诉引发的。
截至到2024年2月,FDA共发布了五次不符合通知,全部是由CDER发出,其中2021年3次,2022年1次以及2023年1次,不符合事项主要是不符合临床试验提交的要求(表1)。
表1 FDA发布的有关ClinicalTrials.gov不符合通知
|
责任方/ 提交方 |
不符合通知号 |
不符合通知 |
回复函(如有) |
民事罚款金额(如有) |
|---|---|---|---|---|
|
Light Sciences Oncology |
NCT02326454 |
|
||
|
Ocugen |
NCT03785340 |
|
||
|
Petrikovets, Andrey M.D. |
NCT03052816 |
|
||
|
Accuitis Inc. |
NCT03064438 |
|
||
|
Acceleron Pharma, Inc. |
NCT01727336 |
|
虽然目前FDA只是发布不合规通知,还没有采取具体处罚措施;但是这种可能性是存在的。
中国过去临床试验质量如何?2015年7.22事件的结果已经告知大家当时的情况。虽然经过7.22事件的整顿,目前国内药监部门对于每个临床试验都采取核查态度,但是一些行业新闻透漏的信息,还是提示我们要谨慎对待这个问题。
结合上面FDA拟采取的行动,中国药监部门如果要树立监管权威,并且让中国临床数据的质量得到世界各国药政部门的认可,还需要采取更多行动来捍卫这个期望。
参考资料:
1-FDA官网信息。
作者简介:zhulikou431,高级工程师、PDA会员、ISPE会员、ECA会员、PQRI会员、资深无菌GMP专家,在无菌工艺开发和验证、药品研发和注册、CTD文件撰写和审核、法规审计、国际认证、国际注册、质量体系建设与维护领域,以及无菌检验、环境监控等领域皆具有较深造诣。近几年开始着力关注制药宏观领域趋势分析和制药企业并购项目的风险管理工作。



合作咨询
![]() 肖女士
肖女士
![]() 021-33392297
021-33392297
![]() Kelly.Xiao@imsinoexpo.com
Kelly.Xiao@imsinoexpo.com
 2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57
2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57