药品研发和注册是一项复杂的智力活动,既消耗大量的资金和时间,也需要大量专业人员进行密集的技术交流沟通。针对人类这项复杂的技术活动,各国药政机构都发布了大量的研发沟通指南来协助解决这些复杂的问题。
本文将对目前中国NMPA发布的各项研发沟通制度进行梳理和分析,解释其中最新技术要求,以资借鉴。
第一部分:研发沟通的法规依据
2020版《药品注册管理办法》对于药品研发工作的沟通交流有明确要求:
第十三条国家药品监督管理局建立药品加快上市注册制度,支持以临床价值为导向的药物创新。对符合条件的药品注册申请,申请人可以申请适用突破性治疗药物、附条件批准、优先审评审批及特别审批程序。在药品研制和注册过程中,药品监督管理部门及其专业技术机构给予必要的技术指导、沟通交流、优先配置资源、缩短审评时限等政策和技术支持。
第十六条申请人在药物临床试验申请前、药物临床试验过程中以及药品上市许可申请前等关键阶段,可以就重大问题与药品审评中心等专业技术机构进行沟通交流。药品注册过程中,药品审评中心等专业技术机构可以根据工作需要组织与申请人进行沟通交流。
沟通交流的程序、要求和时限,由药品审评中心等专业技术机构依照职能分别制定,并向社会公布。
第二部分:研发沟通的关键法规指南汇总
通过对中国药政机构官网的信息搜集和梳理,目前中国药政部门发布了如下涉及药品研发沟通交流的文件。
表1-中国药品研发沟通交流文件汇总表
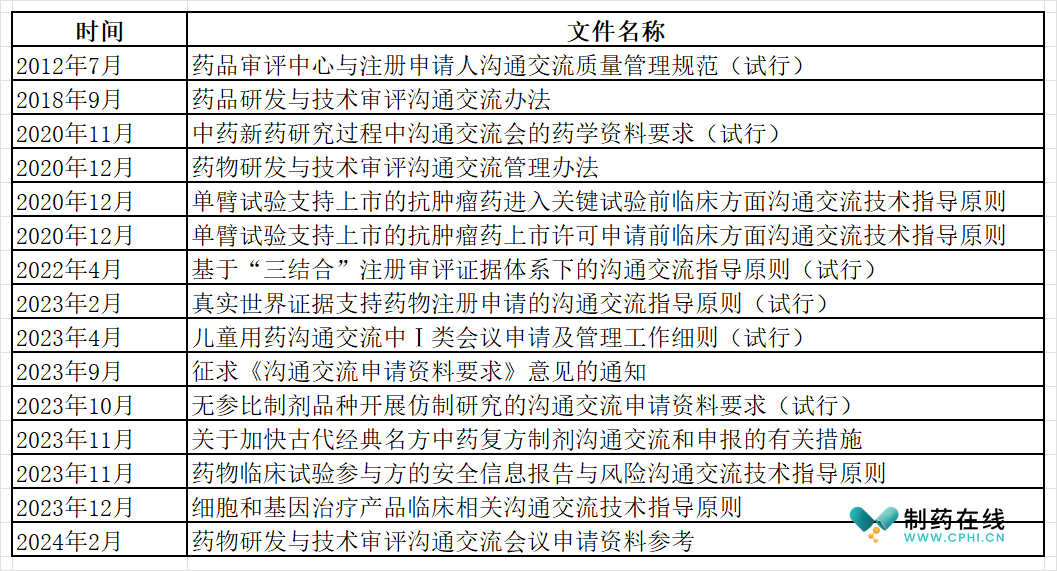
分析:根据上面汇总和梳理,可以看到CDE对于研发中疑难问题的沟通件交流工作开始于2012年;而且随着药政体系的改革,从2018年以后,各类配套文件发布的速度明显加快。可以预见的是,随着药政体系改革力度进一步加强,估计CDE还会发布针对其他研发领域的沟通交流制度。
第三部分:沟通技术信息的最新要求
2024年2月7日,CDE发布《国家药监局药审中心关于发布 《药物研发与技术审评沟通交流会议申请资料参考》的通知》(2024年第48号),针对药品研发中沟通交流递交资料的技术要求提出新要求,以促进沟通交流的效率和质量。
这份新发布的文件对于药品研发沟通交流的技术内容分为四大部分来介绍,分别是中药沟通交流会议申请资料参考、化药生物制品I 类沟通交流会议申请资料参考、化药生物制品II 类沟通交流会议申请资料参考、化药生物制品Ⅲ类沟通交流会议申请资料参考。
为了便于读者学习,整理汇总如下表格。现在拿1.1类中药复方制剂研发中的沟通内容为例来介绍。
表2-中药沟通交流会议申请资料要求表
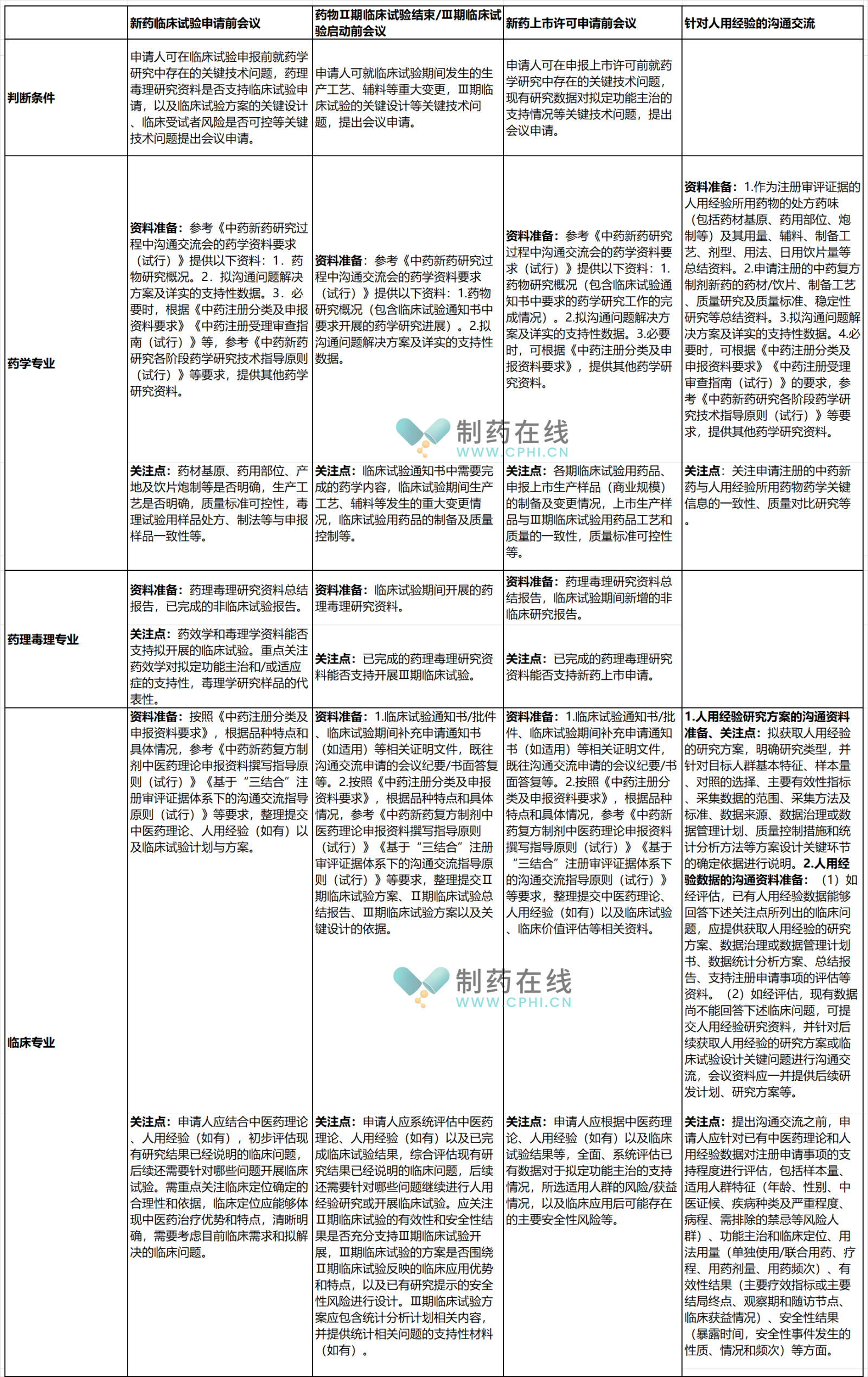
分析:通过上面表格,就中药创新药的研发沟通交流而言,CDE文件根据研发的不同阶段,从判断条件、药学专业要求、药理毒理专业要求、临床专业要求等方面展开,给MAA准备沟通交流资料工作列出了具体要求,可以明显提高工作效率和质量。限于篇幅,其他研发类别的技术内容不再列举,请制药同仁自行学习。
总结
结合上面的介绍和信息排列,可以看出,中国药政当局针对各类药品研发项目的沟通交流工作已经制定了很多配套制度和具有实操性的文件;可以预见的时候,以后类似文件会得到不断补充和更新。这些工作对于解决MAA疑难问题,促进药品研发工作快速有效开展,必将发挥积极作用。
作者简介:zhulikou431,高级工程师、PDA会员、ISPE会员、ECA会员、PQRI会员、资深无菌GMP专家,在无菌工艺开发和验证、药品研发和注册、CTD文件撰写和审核、法规审计、国际认证、国际注册、质量体系建设与维护领域,以及无菌检验、环境监控等领域皆具有较深造诣。近几年开始着力关注制药宏观领域趋势分析和制药企业并购项目的风险管理工作。
相关阅读:
《龙年谈之二:2020-2023年中国企业欧盟认证情况梳理和趋势分析》




合作咨询
![]() 肖女士
肖女士
![]() 021-33392297
021-33392297
![]() Kelly.Xiao@imsinoexpo.com
Kelly.Xiao@imsinoexpo.com
 2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57
2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57