这是一组回顾过去五年中国药政体系演变的文章,也算蹭流量的文章。如果你见识深刻,立意高远,请不要看,这组文章估计会浪费你的时间。
本篇文章主要介绍过去五年中国药物警戒法规和相关工作的最新进展,以及配套文件在过去5年的发展和演变,可以让制药同仁回望走过的路,以资借鉴。
第一部分:2021版GVP发布之前的PV监管历史
虽然在提到药品基本属性时,一般这样说-安全、有效、质量可控。然而,在很长一段时间,中国药政当局对于药品安全的重视程度是很不够的。下面表格将汇总梳理2021年之前中国药政当局发布的、涉及药品安全管理的重要法规文件:
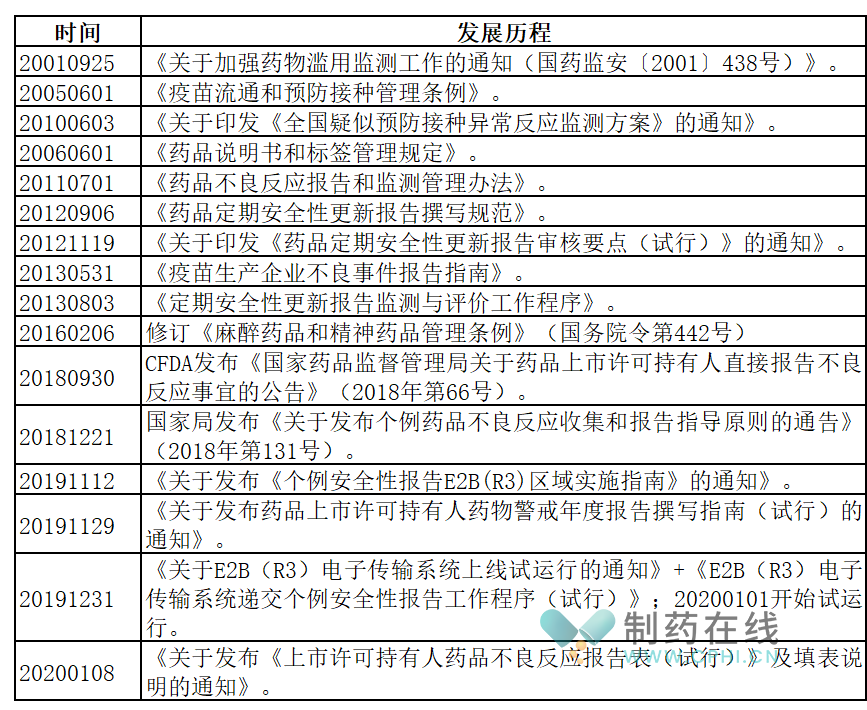
分析:从21世纪初叶开始,中国药政部门就持续关注药品对患者造成的安全影响,并陆续出台系列文件。
以《药品不良反应报告和监测管理办法》发布为标志,中国药品不良反应监管工作进入一个相对规范的时代。后来,随着中国药监局加入ICH,对于药物警戒工作监管开始逐步和国际接轨。在这些工作基础上,最终迎来了2021版GVP的发布和实施。
第二部分:2021版GVP要点和配套文件发布情况
2021年,国家局发布了《药物警戒质量管理规范》。就这份文件题目,就值得制药同仁注意。为啥不叫药品,而是称之为药物?
分析:虽然目前中国药政法规只对药品进行了定义(而且定义也不完美,经常引发歧义);但是对药物的定义,至今无准确和清晰定义。从目前国家药监局发布的各类文件,可以感知一个规律:在上市前,一般称为药物;在上市后,一般称为药品。
2.1-2021版GVP历史进程和技术要点

分析:2021版《药物警戒质量管理规范》主要内容如下:
---因为适用于上市前临床阶段和上市后药品警戒工作,因此文件名称被称为药物警戒质量管理规范。
---2021版《药物警戒质量管理规范》涵盖9章,134条。
---2021版GVP明确提出药物警戒工作的质量目标。
---2021版GVP对企业GVP体系建设,提供了明确要求。
---2021版GVP引入了QRM作为药物警戒工作的管理手段。
---针对临床阶段的药物,2021版GVP也是适用的。
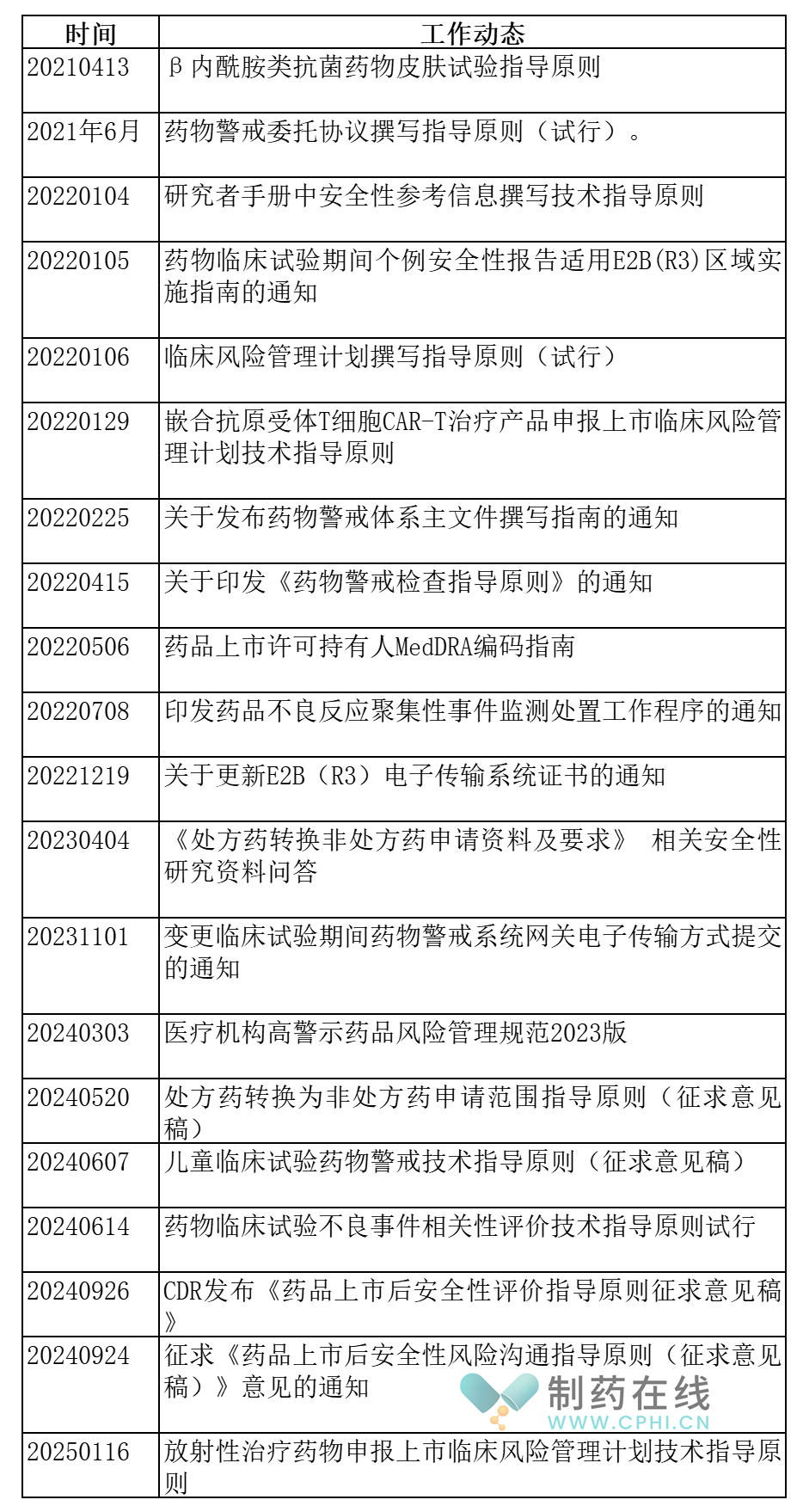
2.2-2021版GVP配套文件梳理
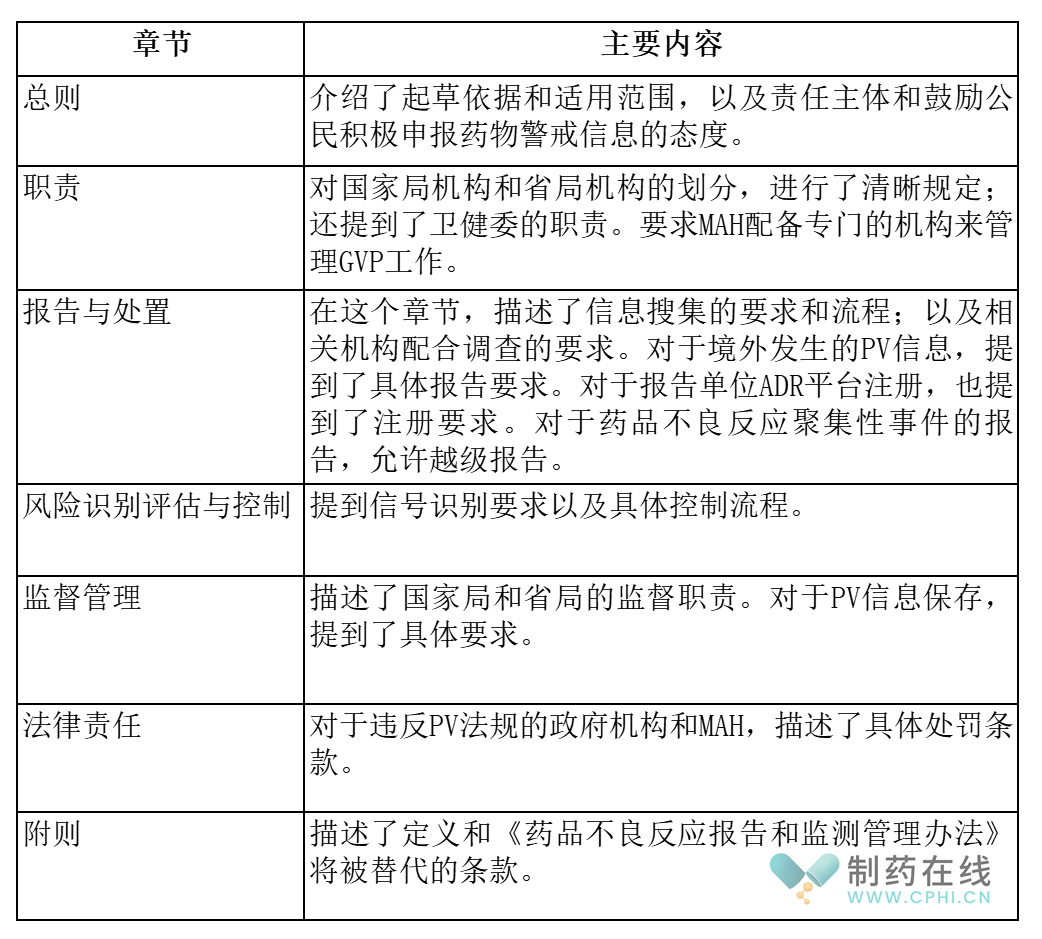
第三部分:2024年流传的《药物警戒(上市后)管理办法》要点
针对GVP和《不良反应管理办法》的关系和内容协调,国家局一直有更多考虑。2023年开始,互联网上流传一份内部稿《药物警戒(上市后)管理办法》。下面采用列表方式介绍这份流传的内部稿的主要内容。
第四部分:各省发布药物警戒检查指南情况梳理
为了规范本省的GVP工作,并和2021版GVP相协调,很多省局发布了本省的一些配套文件。下面汇总和梳理如下:
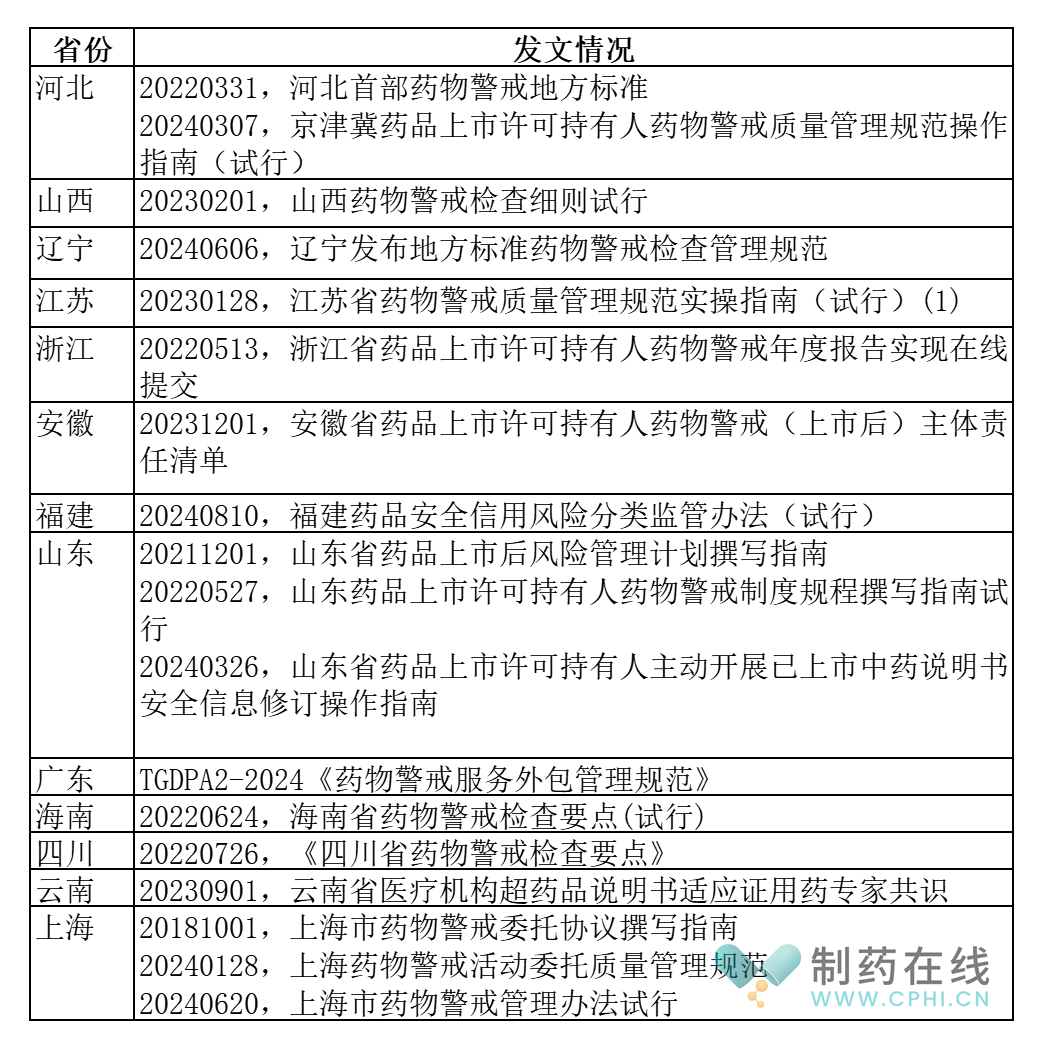
分析:上述信息可能有遗漏,需要读者自行检索和补齐。总之,在中国2021版GVP发布后,各个省局也积极作为,发布了适合本省GVP工作的配套文件,并不断深化这项工作。
第五部分:疑难问题讨论
问题01-MAH的药物警戒部门是否必须独立设置?
分析:2021版GVP第十九条提到,持有人应当建立药品安全委员会,设置专门的药物警戒部门,明确药物警戒部门与其他相关部门的职责,建立良好的沟通和协调机制,保障药物警戒活动的顺利开展。
从上述内容看,目前国家局法规未强制要求MAH必须设立独立的PV部门,可以在QA部门下面设置相对独立的GVP管理机构。如果某个省局有更具体要求,MAH应该遵守所在地省局要求。
问题02-目前在国家局ADR官网上有独立递交GVP信息渠道的是哪些公司?
分析:截止到2025年2月8日,登录国家药监局ADR官网,可以看到下面截图:

因此,可以判定,目前需要注册并向药监局汇报PV信息的机构是MAH、医疗机构和药品经营企业。公民个人还没有直接上报渠道。
更多文章,请关注系列文章《五年风雨回顾》。
系列文章推荐:
作者简介:zhulikou431,高级工程师、PDA会员、ISPE会员、ECA会员、PQRI会员、资深无菌GMP专家,在无菌工艺开发和验证、药品研发和注册、CTD文件撰写和审核、法规审计、国际认证、国际注册、质量体系建设与维护领域,以及无菌检验、环境监控等领域皆具有较深造诣。近几年开始着力关注制药宏观领域趋势分析和制药企业并购项目的风险管理工作。




合作咨询
![]() 肖女士
肖女士
![]() 021-33392297
021-33392297
![]() Kelly.Xiao@imsinoexpo.com
Kelly.Xiao@imsinoexpo.com
 2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57
2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57