这是一组回顾过去五年中国药政体系演变的文章,也算蹭流量的文章。如果你见识深刻,立意高远,请不要看,这组文章估计会浪费你的时间。
本文是这组文章的第一篇,主要介绍《药品管理法》和配套文件在过去5年的发展和演变,让制药同仁经常回望走过的路,以资借鉴。
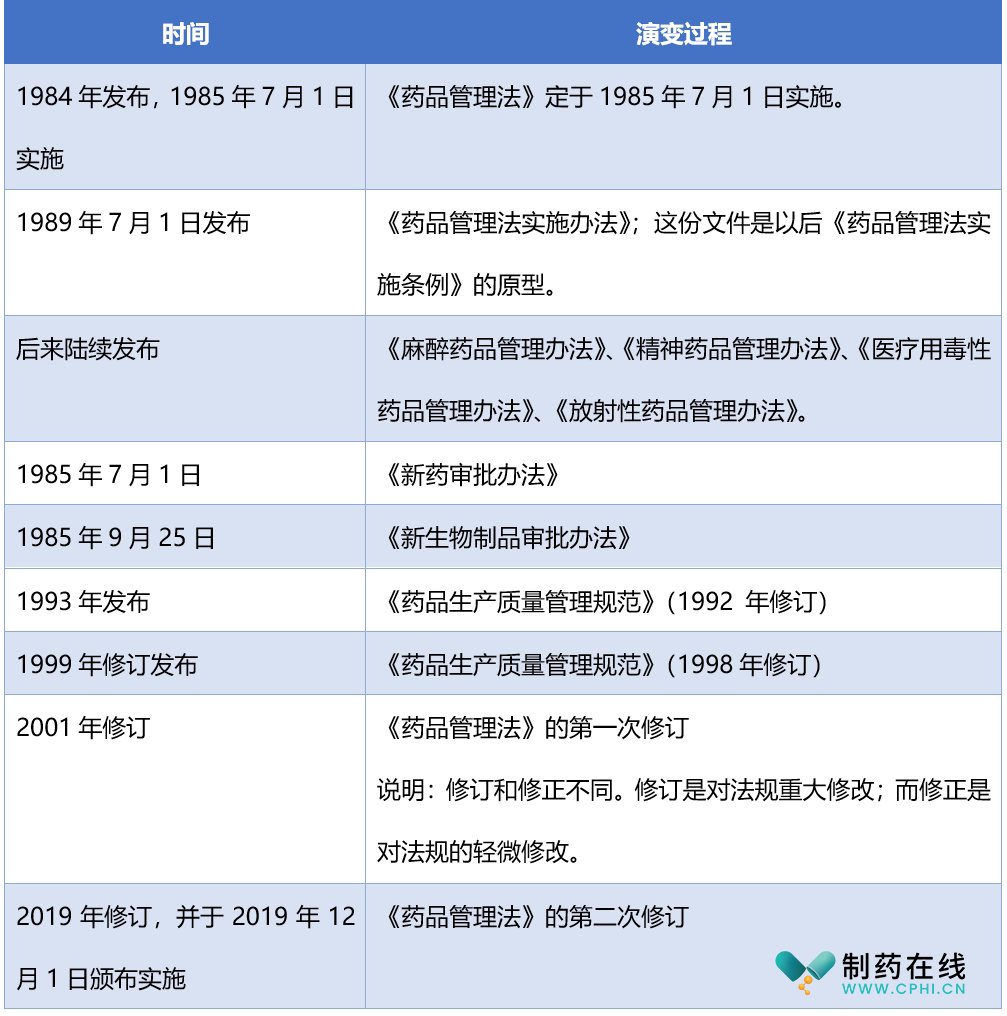
第一部分:药品管理法本身发展历史
◆1985版《药品管理法》之前的药品管理法规

◆1985年版《药品管理法》演变历程
1985年实施的《药品管理法》在实施后,就发现和现实有不一致的地方,本身经历了很多岁月风霜。下面表格将汇总和梳理药品管理法至今的演变历程。
第二部分:2019年修订药品管理法各省反馈
在2019年12月1日药品管理法修订版发布后,很多省局都积极学习。但是随着学习的深入,很多省局都产生了困惑。其中,贵州和山东省局敢为天下先,积极向国家局发函问询,下表将汇总这些信息:

分析:感谢山东省局和贵州省局积极学习,积极提问的态度;他们的工作促进了对法条和某些关键概念的认知。
第三部分:各省发布药品管理法配套文件情况梳理
第一百一十七条 生产、销售劣药的,没收违法生产、销售的药品和违法所得,并处违法生产、销售的药品货值金额十倍以上二十倍以下的罚款;违法生产、批发的药品货值金额不足十万元的,按十万元计算,违法零售的药品货值金额不足一万元的,按一万元计算;情节严重的,责令停产停业整顿直至吊销药品批准证明文件、药品生产许可证、药品经营许可证或者医疗机构 制剂许可证。
生产、销售的中药饮片不符合药品标准,尚不影响安全性、有效性的,责令限期改正,给予警告;可以处十万元以上五十万元以下的罚款。
分析:显然,根据上面这段要求;如果制药企业生产的中药饮片不符合药品标准,但是还不影响安全性、有效性的,可以不把这些饮片视为劣药,而是对企业要求限期改正,给予警告;自然省局也可以进行适当罚款。
下面表格将把截止到2024年10月初,中国大陆各省份药政机构发布的和2019年修订《药品管理法》的配套文件;让全国制药同仁可以回望走过的历程,感受这部最新药政大法对行业的深刻影响。
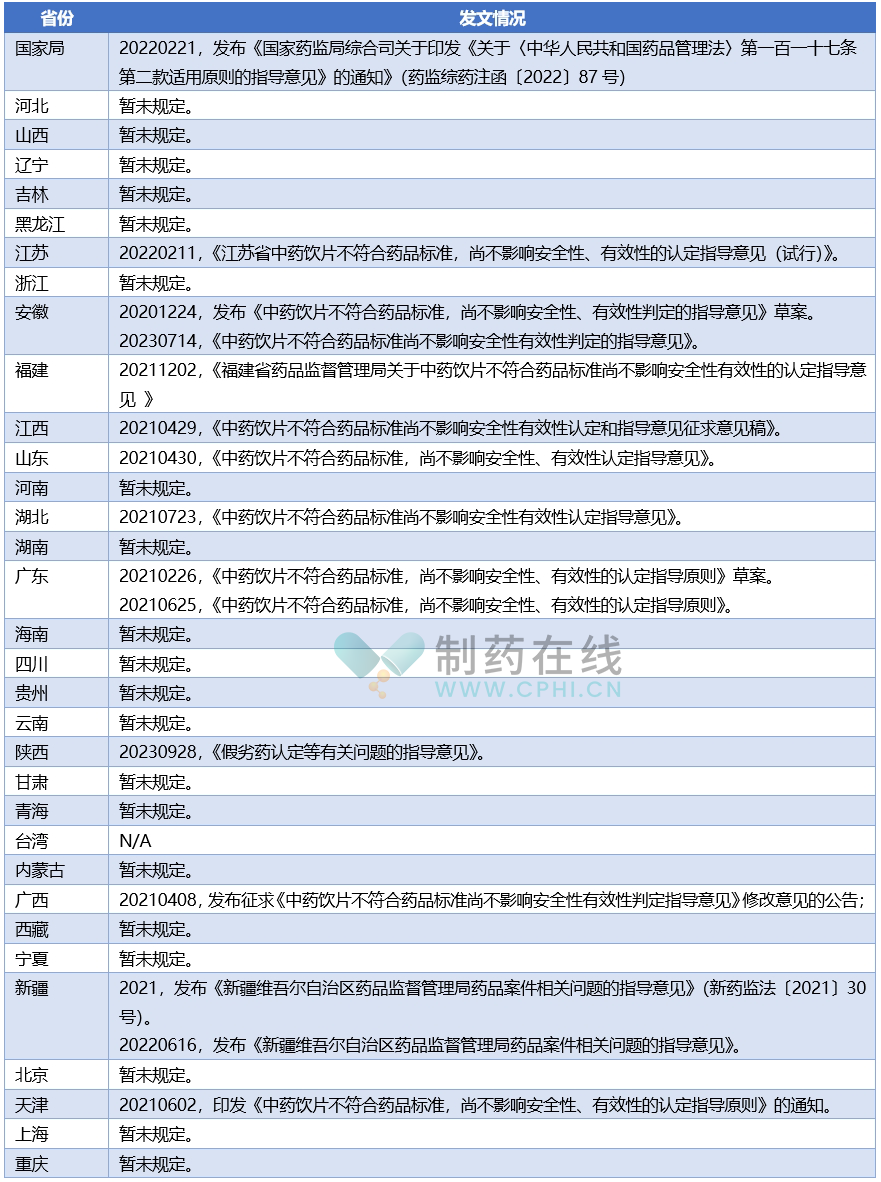
说明:上述表格信息来自各省局官网检索和对识林数据库检索,如果有遗漏,请提醒。
第四部分:典型问题讨论
问题1-药品和药物定义区分
关于这个问题,目前在中国药政官方文件中无明确规定。但是如果读者很细心,会从不同文件命名规律中得到一些线索。例如,药品获得行政许可之前的文件,多用药物;而管理商业化上市对象的行政文件,多用药品。
问题2-药品准确范围?
到本文发文截止,即2024年10月份上旬,中国大陆地区对药品定义的范围是:中药制剂、化药制剂、生物制品制剂(含原液)。
原料药不是药品,但是按照药品管理;同样,饮片不是药品,也按照药品管理。
辅料和包材不是药品,也不按照药品管理。
生物制品无原料药概念,然而由于历史上特殊原因,胰岛素这个品种是存在胰岛素原料药批文的。
问题3-药物警戒部门是否需要独立设置?
根据2021版《药物警戒质量管理规范》,MAH应该设立专门的药物警戒部门,没有强制要求设立独立的药物警戒部门。同样,2024年9月份网络流传的《药物警戒(上市后)管理办法(征求意见稿)》也提到:

目前,是否MAH要设立独立的药物警戒部门,需要看各省局具体要求了。
如果想了解更多中国药政变革过去五年走过的历程,参见系列文章下一篇《五年风雨回顾-药品生产监督管理办法》。
作者简介:zhulikou431,高级工程师、PDA会员、ISPE会员、ECA会员、PQRI会员、资深无菌GMP专家,在无菌工艺开发和验证、药品研发和注册、CTD文件撰写和审核、法规审计、国际认证、国际注册、质量体系建设与维护领域,以及无菌检验、环境监控等领域皆具有较深造诣。近几年开始着力关注制药宏观领域趋势分析和制药企业并购项目的风险管理工作。




合作咨询
![]() 肖女士
肖女士
![]() 021-33392297
021-33392297
![]() Kelly.Xiao@imsinoexpo.com
Kelly.Xiao@imsinoexpo.com
 2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57
2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57