
这是一组回顾过去五年中国药政体系演变的文章,也算蹭流量的文章。如果你见识深刻,立意高远,请不要看,这组文章估计会浪费你的时间。
本文是这组文章中的一部分,主要介绍中国药品标准这看似简单,实则复杂的历史纠缠。本文将主要介绍《药品标准管理办法》和《中药标准管理专门规定》以及配套文件在过去5年的发展和演变,让制药同仁可以回望走过的路,以资借鉴。
因为本文内容非常复杂,提醒读者务必静心静气阅读。本文不涉及兽药质量标准、化妆品质量标准、器械质量标准、食品和保健食品质量标准等内容;另外,本文也不涉及世界其他国家和地区对药品质量标准管理内容,只讨论中国大陆地区对药品标准管理的内容,请务必知悉。
第一部分:药品标准的定义
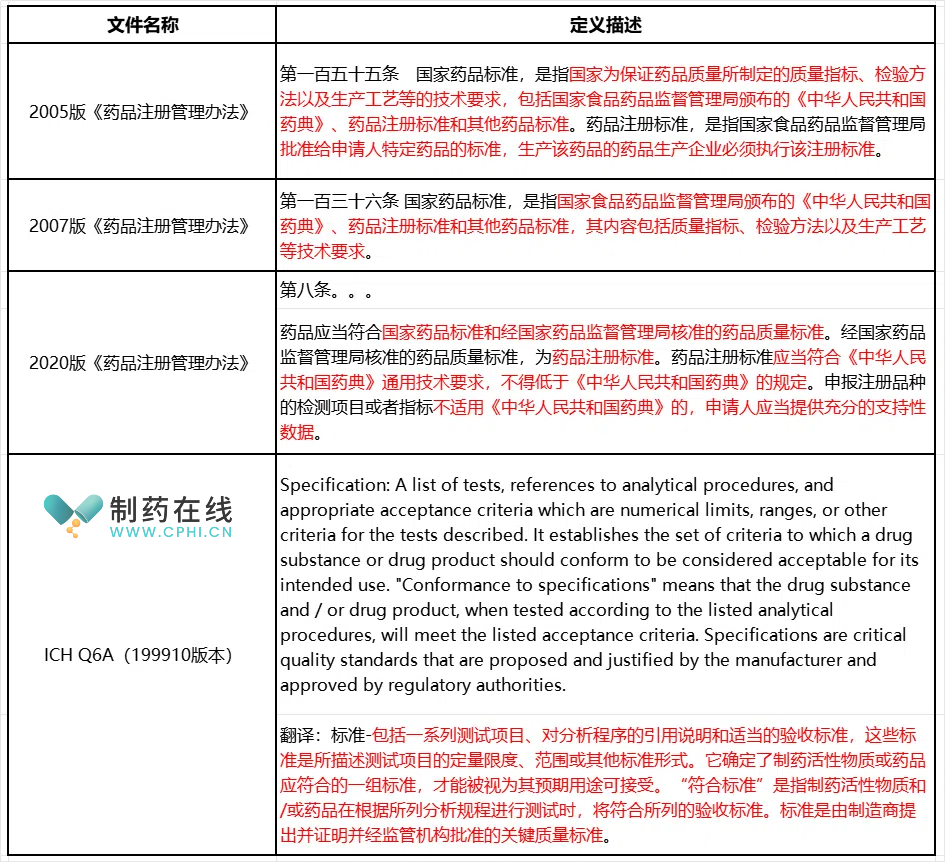
对于这个简单问题,估计问10位制药技术人员,会得到10个不同的答复。下表简单汇总了来自较权威法规和指南的定义:
分析:
---鉴于2017年6月19日,中国药监局宣布加入ICH,而且还发公告要采用ICH Q6A,因此上述表格也收集了相关内容。
---从上面各份法规或者指南给质量标准定义可以看出,完整的质量标准不是一些检测项目的组合,而是检测项目、合适限度和分析规程的组合。甚至,对于复杂的药品,例如中药和生物制品,质量标准还需要涵盖处方或者生产工艺。
第二部分:2007版《药品注册管理办法》的规定解析
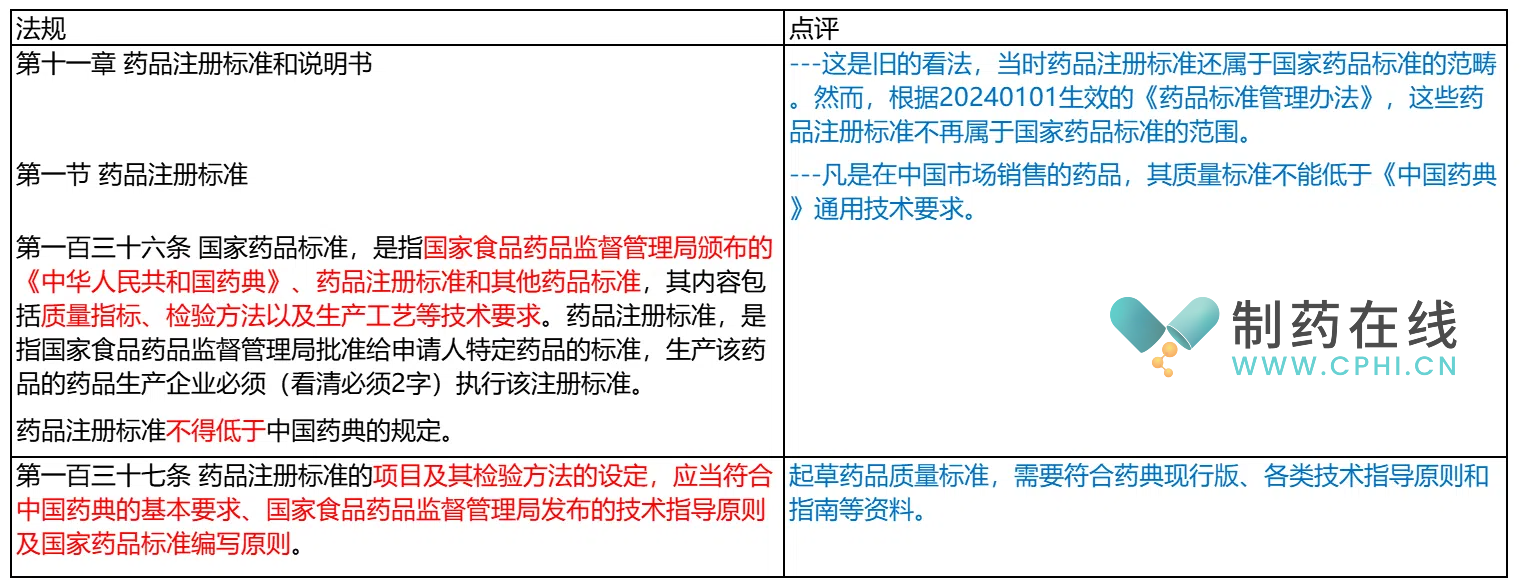
第三部分:2020版《药品注册管理办法》的规定解析

分析:对于未通过关联审评审批的化学原料药、辅料及直接接触药品的包装材料和容器产品呢,如果要变更怎么办?目前好像文件说了,又没有说清。
基本操作套路:企业启动公司内部变更,科学评估,科学实施这些变更。然后在年报中提交这些变更。
第四部分:2023版《药品标准管理办法》的坎坷身世和配套文件
这份重要的文件,穿透历史迷雾来到人间,真的不容易。下面表格汇总了笔者掌握的历次起草和征集意见过程:
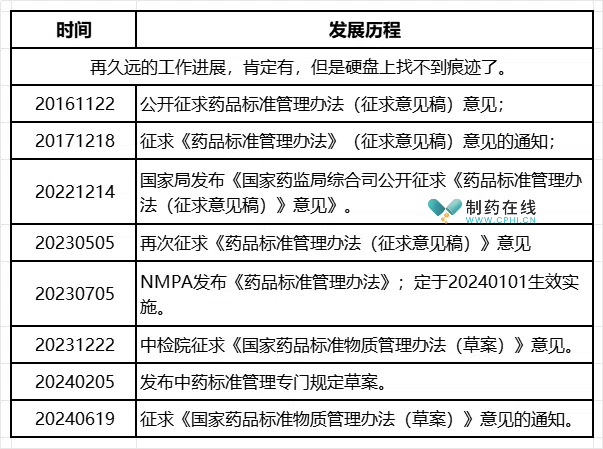
分析:根据国家局工作安排,目前还缺少药典委那份配套文件的征求意见稿。
对于这份文件,很多条款比较难以理解。下面介绍这份文件中的特殊条款:
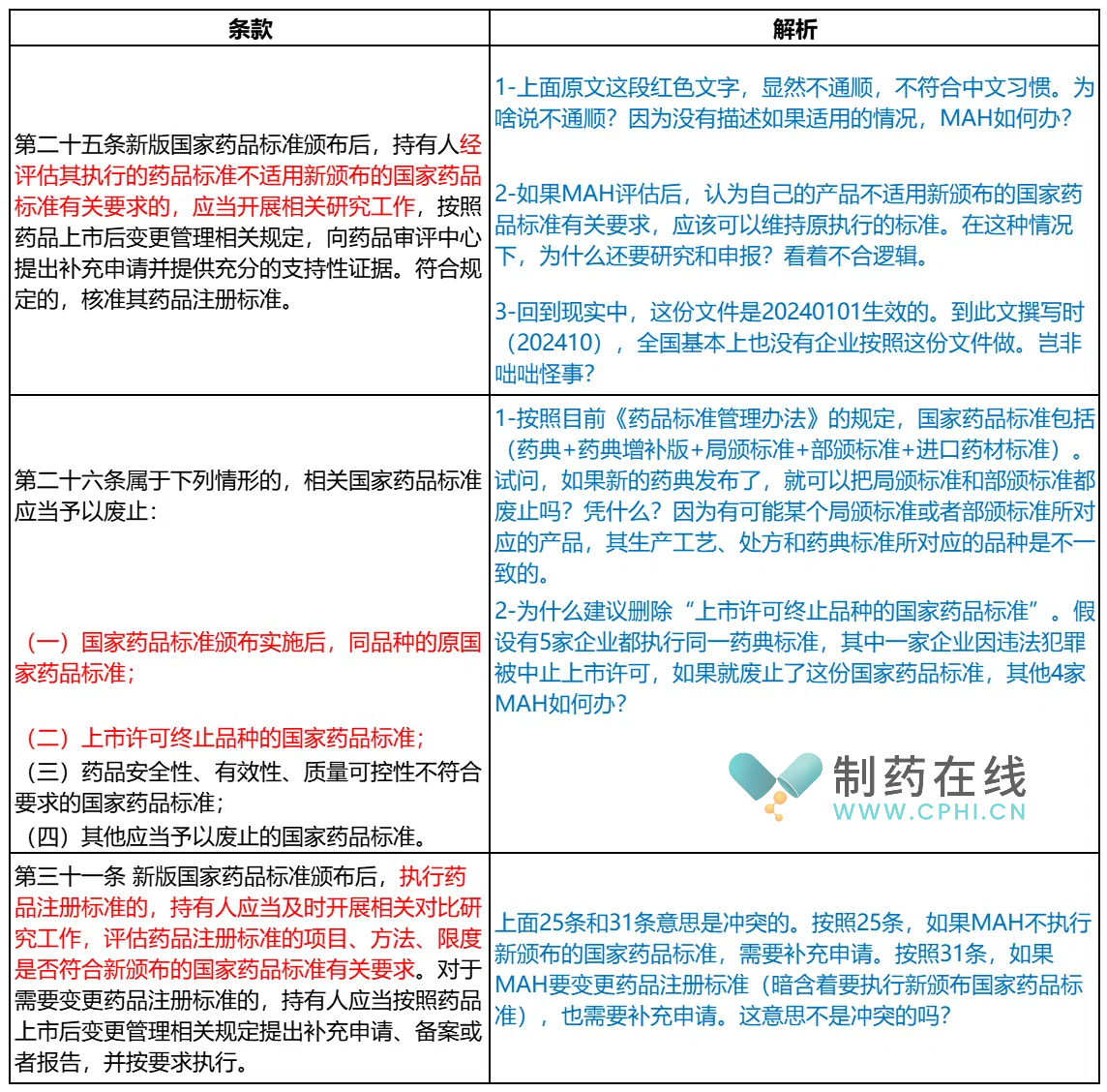
综合分析:这份文件其他段落也有部分问题,只是上面这几句问题最突出。最核心的矛盾还在,这份文件已经在20240101生效,然而现实资源和执法环境是不匹配的,因此,这份文件目前很尴尬。
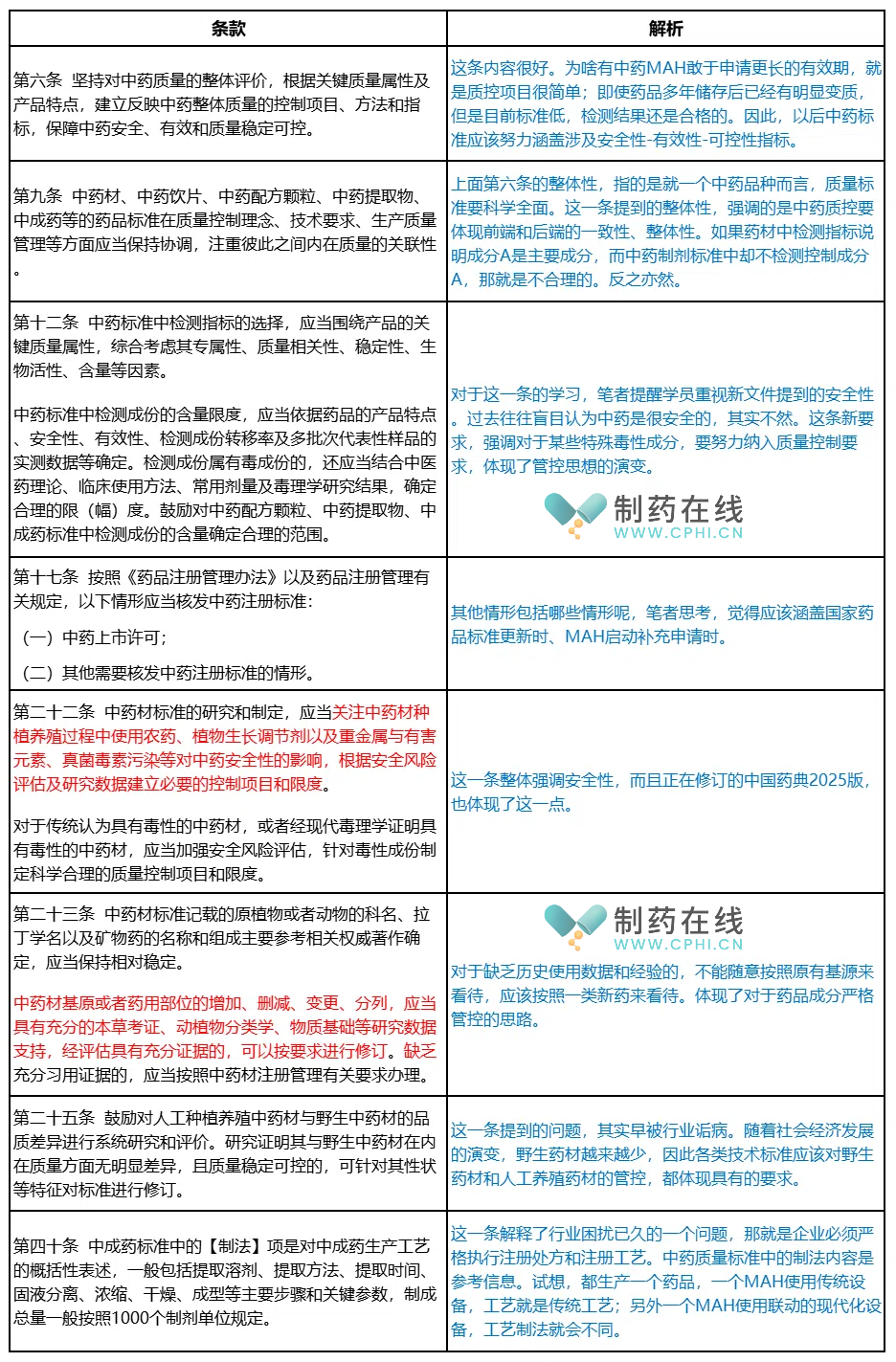
第五部分:2024版《中药标准管理专门规定》的发展历程和要点介绍
下面表格汇总了笔者掌握的《中药标准管理专门规定》的历次起草和征集意见过程:

下面介绍这份文件中的争议问题和重点条款:
第六部分:各省发布的涉及药品标准的文件梳理
在目前中国药品标准体系中,省局负责发布的标准涵盖省级饮片炮制规范、省级中药 配方颗粒标准、各省的药材标准。很多省局发布了本省的上述标准,由于内容很多,本部分不展开赘述。
第七部分:原料药标准的额外解析
20240101生效的《药品标准管理办法》提到:
第四十九条 化学原料药的标准管理按照本办法执行。
分析:目前中国大陆地区对化学原料药按照药品管理,这样写,粗略看是可以接受的。但是还是建议对药品上市许可持有人和登记人的定义,进行清晰规定。国内法规不喜欢增加术语的做法,不是好做法。
第八部分:药用辅料标准的管理思路
20240101生效的《药品标准管理办法》提到:
第五十一条 《中国药典》中药用辅料、直接接触药品的包装材料和容器标准的制定和修订,按照本办法中国家药品标准有关规定执行。药用辅料、直接接触药品的包装材料和容器标准的执行,应当符合关联审评和药品监督管理的有关规定。
分析:笔者认为这一条写的有些粗略。因为原因有三:
---如果一个辅料标准是过去部颁标准或者局颁标准所收载的标准,那么这一条内容就没有涵盖全面。
---对于某个辅料企业单独持有的辅料注册标准,这一条并没有说清如何管理。
---另外,中国大陆地区目前对于辅料采用关联审评制度,并不按照药品管理思路来管理辅料。因此,辅料企业自身对辅料标准的低级别变更,省局不负责备案。因此,辅料质量标准的部分低级别变更,无对应的管理策略。
第九部分:药用包材标准的管理思路
20240101生效的《药品标准管理办法》提到:
第五十一条 《中国药典》中药用辅料、直接接触药品的包装材料和容器标准的制定和修订,按照本办法中国家药品标准有关规定执行。药用辅料、直接接触药品的包装材料和容器标准的执行,应当符合关联审评和药品监督管理的有关规定。
分析:除了上面在辅料质量标准部分提到的问题,还要提醒读者,目前《中国药典》2020版正文未收载直接接触药品的包装材料和容器标准。但是,正在起草和修订的《中国药典》2025版将对包材标准掀起巨大的改变,需要制药企业早做应对策略。
从这份文件内容看,对于即将到来的《中国药典》2025版,这份法规也没有足够的应对策略。




合作咨询
![]() 肖女士
肖女士
![]() 021-33392297
021-33392297
![]() Kelly.Xiao@imsinoexpo.com
Kelly.Xiao@imsinoexpo.com
 2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57
2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57