NMPA在2023年7月5日发布的《药品标准管理办法》没有在当时很快实施,而是将实施日期拖延到2024年1月1日。即使这样,这份重要法规期盼而来的三份文件,近期也只是中检院发布了配套文件的草案-2023年12月22日,中检院官方发布《中检院关于公开征求《国家药品标准物质管理办法(草案)》意见的通知》。
而随着2024年3月份中国药典2020版第一增补版即将正式实施,药品标准实施带来的管理问题,让中国各类企业开始面对抉择的难题。本文将探讨这些难题,并期望NMPA在现实变得更尴尬之前,尽快出台具体措施来厘清问题。
第一部分:中国药品标准如何划分
中国药品标准分为几级,到底有哪些类型的标准?这个看似简单的问题,估计让在制药行业从业多年的人士回答,也会有些困难。因为就这个问题的规定,在过去多年,国家药监局和省局发布的文件众说纷纭,莫衷一是。
2023年7月5日,国家药监局发布《药品标准管理办法》,总算对此问题进行了统一界定和要求:
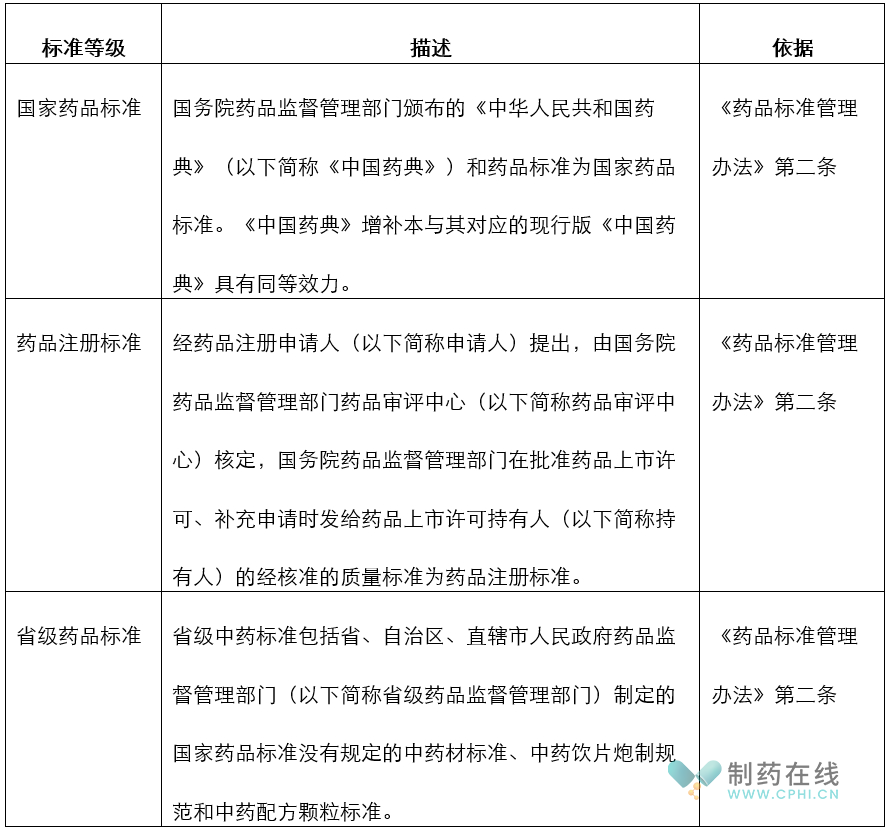
分析:从上面内容看,药典和药典增补版肯定属于国家药品标准,需要严肃执行。
第二部分:2024年1月1日之前国家药品标准实施操作模式
对于这个问题的回答,即使在制药行业从业多年的技术人员也不容易说出清晰的答案。但是多年现实操作,已经告诉行业同仁,如果国家药品标准发布,企业需要采取的态度是---直接实施。
依据01-2020年7月3日,NMPA发布《国家药监局关于实施2020年版《中华人民共和国药典》有关事宜的公告》(2020年 第80号)。其中提到:
六、为符合本版《中国药典》要求,如涉及药品处方、生产工艺和原辅料来源等变更的,药品上市许可持有人、生产企业应按照《药品注册管理办法》以及有关变更研究技术指导原则和药品生产质量管理规范等要求进行充分研究和验证,按相应变更类别批准、备案后实施或报告。
分析:从上面这段可以看出,如果MAH在实施新版药典或者新版药典增补版时,发生药品处方、生产工艺和原辅料来源等变更,才需要按照现行法规和指南规范申报。而对于标准的实施,是设定最后实施日期;在这个实施日期之后,必须实施。官方文件并不要求企业向国家局或者省局申报,但是要在MAH内部执行变更管理系统。
依据02-2021年2月10日,NMPA发布《已上市化学药品药学变更研究技术指导原则(试行)》。其中在药品标准变更部分提到:
对于随国家药品标准变更而引起的注册标准变更,可参照相关公
告要求执行(如,国家药品监督管理局关于实施《中华人民共 和国药典》有关事宜的公告 。
分析:从这段内容看,对于国家药品标准更新引发的MAH的药品标准变更,态度也是允许MAH直接实施,在企业内部做好变更管理即可。
第三部分:2024年1月1日之后国家药品标准实施操作模式
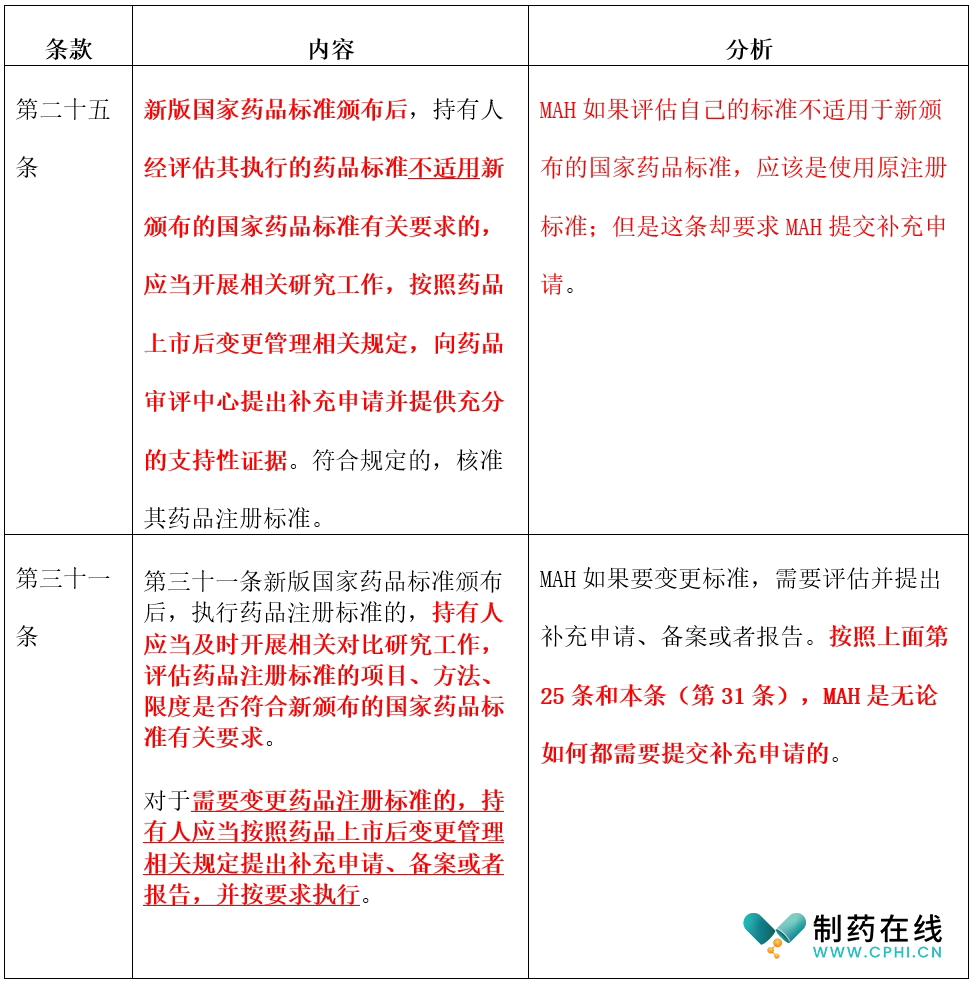
综合分析:估计所有中国MAH面对即将于2024年3月12日生效的中国2020版药典增补版和上面这部即将于2024年1月1日生效的法规,陷入了深深的困惑。
更令人头疼的是,中国CDE对补充申请的审评效率又不是很高。
根据2021年发布的已上市中药-化药-生物制品变更申报资料和受理审查指南等文件,这些变更如果涉及重大变更或者中等变更,官方可能会启动抽检和现场检查。中国企业和向中国进口的国外MAH如果在现在立即递交(还不是启动研发,而是立即递交)补充申请,都估计难以在2024年3月12号之前获得补充申请的批准。
到时候,如果企业产品受到2020版药典增补版影响,是按照旧模式直接实施标准变更,还是大面积停产等待CDE审评?
第四部分:辅料企业将面对的抉择难题
对于一个辅料企业,在2024年1月1日《药品标准管理办法》实施后,也会面对类似困扰。
《药品标准管理办法》第五十一条提到:《中国药典》中药用辅料、直接接触药品的包装材料和容器标准的制定和修订,按照本办法中国家药品标准有关规定执行。药用辅料、直接接触药品的包装材料和容器标准的执行,应当符合关联审评和药品监督管理的有关规定。
这条规定很模糊,根本不具有可操作性。因为:2016年中国实施原辅包关联审评以来,辅料不按照药品管理,辅料注册事项不属于行政许可。现在上面这条要求按照办法中国家药品标准有关规定执行;而现实中,是根本无法执行的。
例如一个辅料企业,如果评估,会根据即将生效的药典增补版进行变更辅料标准;但是辅料企业无法提交补充申请,也无法到省局备案。
第五部分:药品包材企业将面对的抉择难题
简言之,药品包材企业也面对和上面辅料企业类似的问题。因此,本段就不重复论述了。
总结
本来作者还想多唠叨几句,但是思来想去,还是简单明了的表达自己的观点更好---《药品标准管理办法》应该立即停止实施,并对上述不合适条款启动修订。
系列文章:《兔年谈之一:欧盟关键法规和指南检索应用》、《兔年谈之二:FDA指南更新计划释放行业监管新信号》、《兔年谈之三:中药研发之激战2023》、《兔年谈之四:中国药品标准体系的演变点滴》、《兔年谈之五:燕京来文惊初夏,深夜香茗感雪风 ---也谈<20230524关于加强委托生产药品上市许可持有人监管工作的通知征求意见稿>》、《兔年谈之六-2025版中国药典渐显真容之(一)》、《兔年谈之七:2025版中国药典渐显真容之(二)》、《兔年谈之七:美国药品短缺数据分析和展望》、《兔年谈之八:中美欧三方GMP问答对比分析》、《兔年谈之九:EDQM-CEP认证进入2.0时代》、《兔年谈之十:NMPA加入PIC/S进度和PIC/S GMP最新变化介绍》、《兔年谈之十一:大洋彼岸之风带来FDA对亚硝胺杂质控制新进展》、《兔年谈之十二:上海药品变更管理文件的进步和不足》、《兔年谈之十三:欧盟技术问答揭示的生物制品注册新要求》、《兔年谈之十四:岁末年首聊聊MAH相关疑难问题》
作者简介:zhulikou431,高级工程师、PDA会员、ISPE会员、ECA会员、PQRI会员、资深无菌GMP专家,在无菌工艺开发和验证、药品研发和注册、CTD文件撰写和审核、法规审计、国际认证、国际注册、质量体系建设与维护领域,以及无菌检验、环境监控等领域皆具有较深造诣。近几年开始着力关注制药宏观领域趋势分析和制药企业并购项目的风险管理工作。




合作咨询
![]() 肖女士
肖女士
![]() 021-33392297
021-33392297
![]() Kelly.Xiao@imsinoexpo.com
Kelly.Xiao@imsinoexpo.com
 2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57
2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57