欧盟作为国际主要医药市场,也是中国制药行业高度关注的目标之一。本文将介绍截止目前最新的欧盟关键法规和指南的检索应用情况,希望可以对业界同仁有所裨益。
第一部分:欧盟人药管理法律检索
https://health.ec.europa.eu/medicinal-products/eudralex/eudralex-volume-1_en
在上面地址,可以检索到欧盟针对人药管理的主要法律法规。
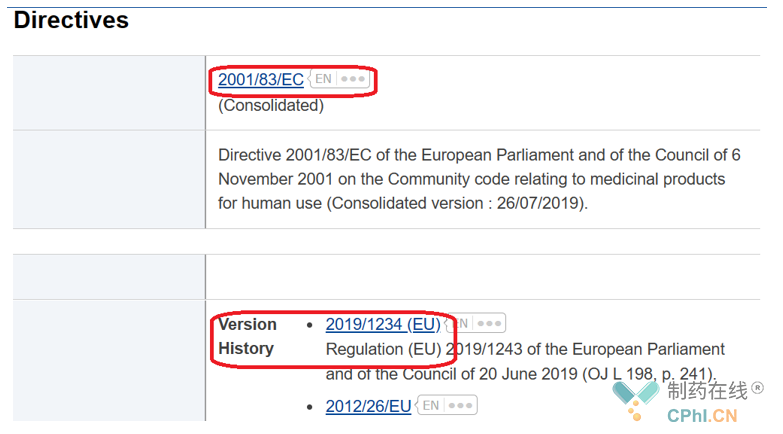
根据官网信息,可以指导针对人药管理的法规主要分为指令(Directives)和条例(Regulations);在主要法规下面是历次修订情况。
第二部分:人药上市申请须知
https://health.ec.europa.eu/medicinal-products/eudralex/eudralex-volume-2_en
从上面网址进入,可以看到欧盟对于人药申请的规程和文件格式要求。
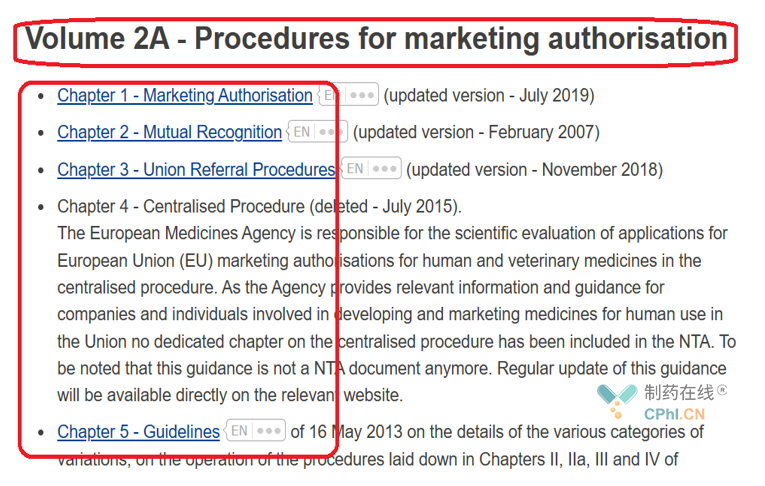
其中A部分是上市申请的规程,分为6章内容。
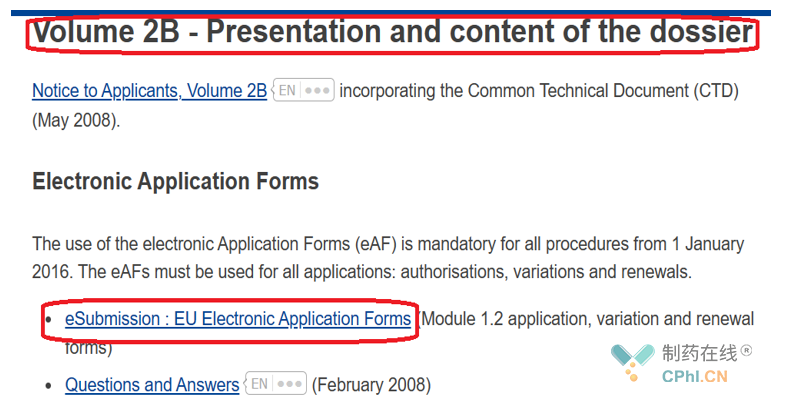
其中B部分是申报资料格式,过去采用CTD格式,现在一般都采用eCTD格式.
第三部分:药品研发指南
在EC官网,通过下面地址可以检索药品研发相关指南:
https://health.ec.europa.eu/medicinal-products/eudralex/eudralex-volume-3_en
在EMA官网,通过下面地址可以看到相同的内容:
https://www.ema.europa.eu/en/human-regulatory/research-development/scientific-guidelines

其中,涉及药品质量研究的问答分为第一部分和第二部分:
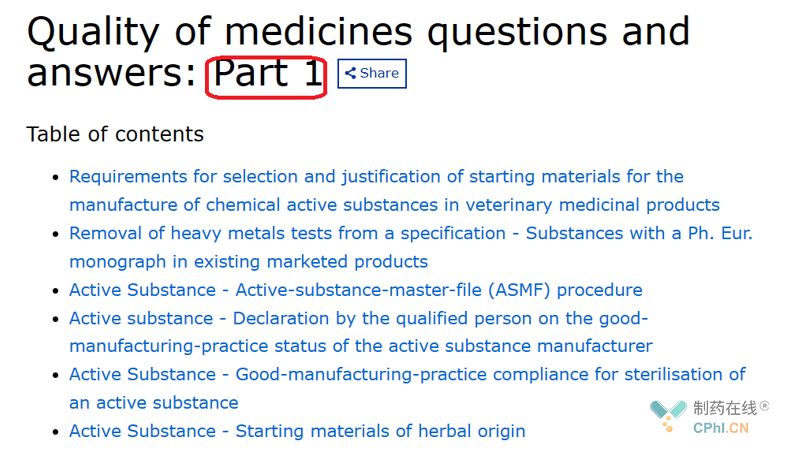
例如如果研发公司想减少对起始物料的测试项目,问答就在第二部分中:

第四部分:欧盟GMP指南
https://health.ec.europa.eu/medicinal-products/eudralex/eudralex-volume-4_en
在上面网址,可以打包下载最新版EU GMP指南。
欧盟GMP分为4部分,下面展示第一部分和附录的截图:
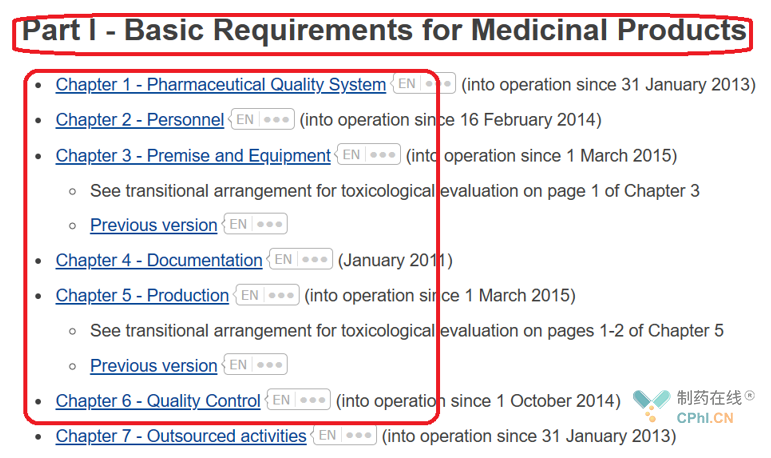
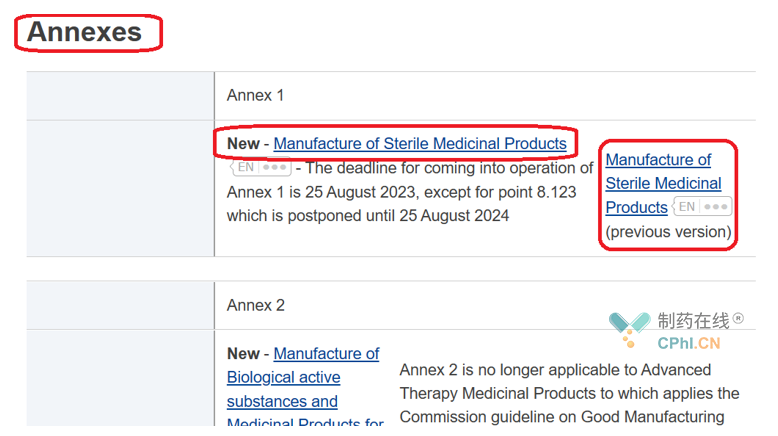
经过统计,欧盟GMP共包括21个附录。
第五部分:欧盟最新临床试验法规
从2022年年初开始,欧盟开始实施新的临床试验条例Regulation EU No 536/2014。下载网址是:
https://eur-lex.europa.eu/legal-content/EN/TXT/?uri=celex%3A32014R0536
和这份新的临床试验条例配套的文件,可以在下面网址找到:
https://health.ec.europa.eu/medicinal-products/eudralex/eudralex-volume-10_en
这些配套文件分为:
Chapter I - Application and application documents
Chapter II - Safety reporting
Chapter III - Quality
Chapter IV - Inspections
Chapter V - Additional documents
Chapter VI - Legislation
总结
虽然欧盟药政法规体系也很庞大,但是网络信息很方便,而且界面相对友好,也很智能化。很多相关文件都在主要文件下面的相关链接里面体现超链接,便于检索和使用。而且主要更新文件和主题文件,有密切相关。
说明:本文不构成任何价值判断和投资建议。
参考文献
1- EC官网信息
2- EMA官网信息
作者简介:zhulikou431,高级工程师、PDA会员、ISPE会员、ECA会员、PQRI会员、资深无菌GMP专家,在无菌工艺开发和验证、药品研发和注册、CTD文件撰写和审核、法规审计、国际认证、国际注册、质量体系建设与维护领域,以及无菌检验、环境监控等领域皆具有较深造诣。近几年开始着力关注制药宏观领域趋势分析和制药企业并购项目的风险管理工作。
【推荐学习】




合作咨询
![]() 肖女士
肖女士
![]() 021-33392297
021-33392297
![]() Kelly.Xiao@imsinoexpo.com
Kelly.Xiao@imsinoexpo.com
 2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57
2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57