2023年2月10日国家药监局发布了《中药注册管理专门规定》,其中指出中药新药的研发应当结合中药注册分类,根据品种情况选择符合其特点的研发路径或者模式,此外《中药注册管理专门规定》还对中药人用经验的合理应用以及中药创新药、中药改良型新药、古代经典名方中药复方制剂、同名同方药等注册分类的研制原则和技术要求进行了明确,未来我国中药新药审批有望进一步加速。另外在1月30日召开的2023年全国中药注册管理和上市后监管工作会议上国家药监局副局长赵军宁表示,2023年将全链条加强中药质量管理,全过程加快中药品种的审评审批。
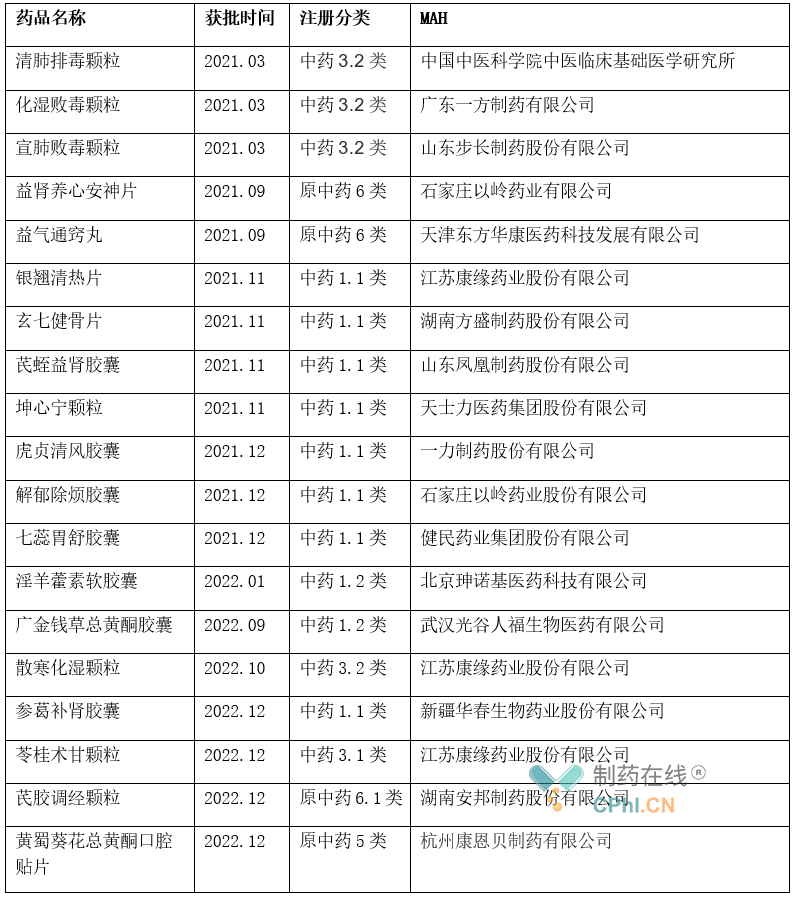
2021年,NMPA共批准中药新药12个,是近几年以来中药创新药获批数量最多的一年。这些中药新药覆盖呼吸系统,神经系统、消化道及代谢和免疫机制调节用药等多个领域,其中包括9个中药创新药,另外3个通过特别审批程序应急批准的清肺排毒颗粒、化湿败毒颗粒和宣肺败毒颗粒则来源于古代经典名方,在抗击新冠肺炎疫情中发挥了重要作用。2022年获批的中药创新药则较少,共有淫羊藿素软胶囊(1.2类)、广金钱草总黄酮胶囊(1.2类)、散寒化湿颗粒(3.2类)、参葛补肾胶囊(1.1类)、芪胶调经颗粒(原中药6.1类)和苓桂术甘颗粒(3.1类)、黄蜀葵花总黄酮口腔(原中药5类)等7款获批上市,其中3款为1类新药。(详见图1)
2020 年9月,国家药监局发布的《中药注册分类及申报资料要求》(2021年1月1日开始实施)明确了将中药注册按照中药创新药、中药改良型新药、古代经典名方中药复方制剂、同名同方药等等进行分类,前三类属于中药新药。改良型新药中"中药增加功能主治"这一细分类别由原来的补充申请改为新药申报范畴,拓宽了改良型新药范畴,鼓励中药企业对已上市药品进行二次开发。古代经典名方中药复方制剂"则鼓励深挖经典名方,向中药新药转化。2022年12月江苏康缘药业获批的新药苓桂术甘颗粒(中药3.1类新药)就是首 个按古代经典名方目录获批上市的中药创新药,该药品处方来源于汉·张仲景《金匮要略》,已列入《古代经典名方目录(第一批)》。
此外,2021年8月27日国家药监局药审中心发布的《按古代经典名方目录管理的中药复方制剂药学研究技术指导原则(试行)》,明确按古代经典名方目录管理的中药复方制剂属于中药注册分类3.1类(以下简称中药3.1类)。
表 1 2021-2022年NMPA批准的中药新药
中医药产业在国家多项行政法规和政策的引领下在持续加速地发展,那么2023年又有哪些中药新药可能获批呢,我们期待一下:
据不完全统计,截止目前已提交NDA上市申请的中药新药有如下几种(详见表2),多为1.1类(中药创新药-中药复方制剂,系指由多味饮片、提取物等在中医药理论指导下组方而成的制剂)还有个别是1.2类(中药创新药-从单一植物、动物、矿物等物质中提取得到的提取物及其制剂)、2.2类(中药改良性新药-改变已上市中药剂型的制剂,即在给药途径不变的情况下改变剂型的制剂)和3.1类(按古代经典名方目录管理的中药复方制剂)。
表 2 已提交上市申请的中药新药
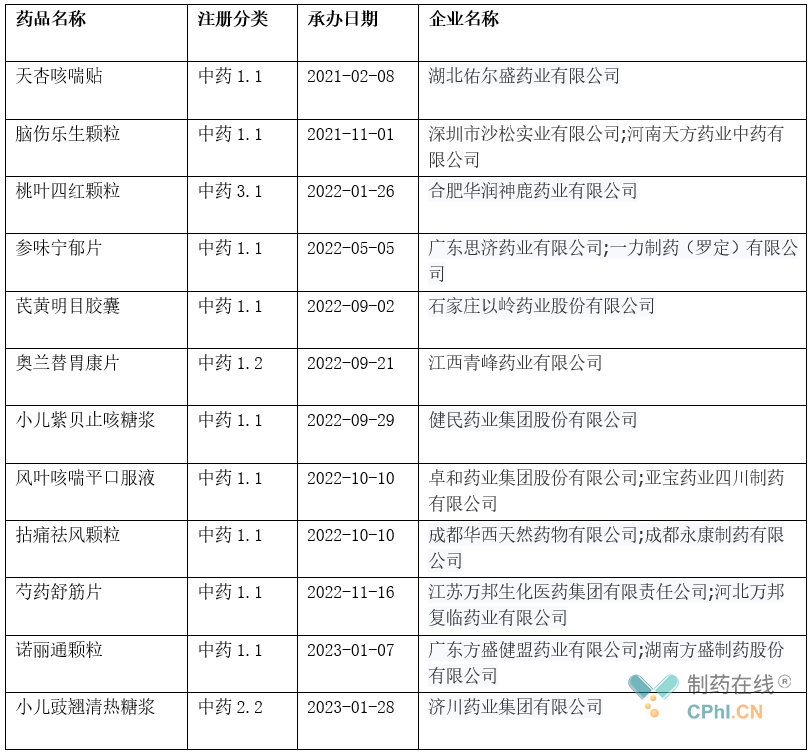
天杏咳喘贴:湖北佑尔盛药业申报的中药1.1类新药,该药是由湖北中医学院研制的中药外治敷贴药膏,主要起到止咳平喘的作用。
脑伤乐生颗粒:国内首 款报产的脑血管中成药1类新药。是由河南天方药业中药与深圳沙松乐生合作研发的中药创新药,具有补气养血、益脑开窍、祛瘀通络的功效,适用于治疗颅脑外伤及颅脑手术后所致的气血虚弱、脑脉受损、瘀滞经络型瘫痪等症。该药曾于2013年向国家药监局提交脑伤乐生颗粒(新药6.1类)上市申请,于2016年主动撤回,2021年11月又以新药1.1类重新提交了上市申请。
桃叶四红颗粒:华润三九子公司合肥华润神鹿药业提交的中药3.1类新药桃红四物颗粒上市申请,用于妇女血虚兼有瘀血的月经不调,为近5年来首 款报产的妇科调经中药新药。
参味宁郁片:由广东思济药业有限公司和一力制药(罗定)有限公司提交的中药1.1类新药,由4种中药植物药组成,是具有自主知识产权的抗抑郁小复方中药,可用于治疗抑郁症(气阴两虚证)。2012年11月,该药按原中药6.1类申报上市,后于2016年月撤回申请。2022年5月,参味宁郁片按中药1.1类再次申请上市。
芪黄明目胶囊:由石家庄以岭药业提交的中药1.1类新药,此次递交的上市申请对应的适应症为治疗糖尿病视网膜病变,该药可以有效降低毛细血管通透性、减轻视网膜及黄斑水肿和出血,同时还有利于稳定患者血糖,遏制住单纯性病变发展成为增值性病变。
奥兰替胃康片:江西青峰药业有限公司自主研发的中药1.2类中药创新药,是由江西道地药材枳实中提取的枳实总黄酮苷提取物制成的口服固体制剂,主要含柚皮苷和新橙皮苷等黄酮苷类 有效成分。用于治疗胃肠运动障碍型功能性消化不良。目前,青峰药业在中成药胃药市场已拿下了猴菇饮口服液、胃灵颗粒及温胃舒泡腾片等产品的生产批文,奥兰替胃康片有望成为其在该领域首 款1类新药。
小儿紫贝止咳糖浆:健民药业积极布局儿科用药产品线,其独家产品龙牡壮骨颗粒2021年在中国城市实体药店终端销售额超6亿元,稳居中成药儿科用药TOP1。小儿紫贝止咳糖浆(小儿宣肺止咳糖浆)是健民药业于2022年9月申报上市的1.1类中药新药,适应症为急性支气管炎及慢性单纯型支气管炎急性发作之咳嗽。
风叶咳喘平口服液:由卓和药业集团股份有限公司和亚宝药业四川制药有限公司提交的中药1.1类新药,该药为呼吸系统疾病用药,可用于治疗急性支气管炎咳嗽。
拈痛祛风颗粒:拈痛祛风颗粒为骨骼肌肉系统疾病用药,由成都永康制药有限公司以中药1类新药申报,该药具有清热利湿、祛风止痛的功效,适用于急性痛风性关节炎(风湿郁热证)。
芍药舒筋片:芍药舒筋片是由复星医药控股子公司江苏万邦及其控股子公司河北万邦复临联合申报的中药1.1类新药,这也是复星医药首 款申报上市的1.1类中药创新药,拟主要用于治疗膝骨关节炎(肝肾不足、筋脉瘀滞证)。该新药为上海中医药大学附属曙光医院著名骨科专家石印玉教授的经典名方,其处方及制备方法已申请专利。处方主要由白芍、秦艽、全蝎等药物组成,在医院临床使用已有多年历史。
诺丽通颗粒:方盛制药申报的中药1类创新药,有利于改善脑供血不足情况,迅速缓解头痛、头晕症状,多年应用于临床治疗反复发作性紧张型头痛。
小儿豉翘清热糖浆:济川药业集团的小儿豉翘清热糖浆为2.2新剂型上市申请,用于小儿风热感冒夹滞证应适应症。小儿豉翘清热颗粒是济川药业的独家品种,已成为10亿级别的产品,如小儿豉翘清热糖浆获批上市将进一步扩大其在细分领域的优势。
枇杷清肺颗粒:由吉林敖东洮南药业股份有限公司,按中药3.1类"应提供按照国家发布的古代经典名方关键信息及古籍记载进行研究的工艺资料" 申报上市。
荆门上清丸:荆门上清丸又称荆门积荫堂上清丸,是荆门传统的中成药产品,源于荆门李氏"老积荫堂"家传的祖 传秘方,该方由儿茶、黄连、荆芥、薄荷、山豆根、射干、甘草、桔梗、硼砂、冰片、麝香等组成,具有清热解毒、消肿止痛的功效。荆门上清丸曾被列为荆门市首批国家级非物质文化遗产,用于咽喉肿痛、口舌生疮、内火牙痛、伤风中暑、风热咳嗽、小便短赤。2008年,湖北齐进药业首次按照中药新药的6.1类标准申报临床,未获得批准。2011年4月,荆门上清丸首次获得临床试验批准,本次为湖北齐进药业有限公司和葵花药业集团(襄阳)隆中有限公司按照中药1.1类申报生产。
苓桂术甘汤颗粒:浙江康恩贝制药股份有限公司按中药3.1类申报,苓桂术甘颗粒来源于古代经典名方苓桂术甘汤,由茯苓、桂枝、白术、甘草四味药组成。该药品处方来源于张仲景《金匮要略》,已列入《古代经典名方目录(第一批)》。康缘药业苓桂术甘颗粒已获批上市,这是首 个按古代经典名方目录管理的中药复方制剂(即中药3.1类新药)。
另外,据不完全统计2022年共有36个中药新药获得临床试验默示许可,较2021年的32个增加了4个。36个中药新药中,1类中药创新药有25个、2类中药改良型新药有11个。
近几年随着国家对中药政策的扶持以及各项行政法规的推行和落实,我们欣喜地看到,中药研发正逐步步入正轨,中药新药质量也向规范化和国际化迈进,中药审评效率大幅改善,中药新药上市申报及获批数量逐渐恢复,中药新药临床申报通过率整体为增长趋势。
2022年12月,CDE发布了《同名同方药研究技术指导原则(试行)》,这也意味着中药仿制研究技术的要求有望被进一步规范。
总结:
随着2023年初《中药注册管理专门规定》的最后定稿发布,关于中药研发和注册的最后一块关键基石已经落地。这部关键文件不仅对于已上市中药的规范管理提出很多要求,而且对于中药新药研发中人用经验的应用、真实世界数据的应用都提出了具体指针。应该说,关于中药研发和注册管理的关键文件都已经完成,剩下的就交给企业决策团队和市场检验了。
参考资料:
1-NMPA官网数据库
2-药智网数据库
3-丁香园insight数据库信息
系列文章:《兔年谈之一:欧盟关键法规和指南检索应用》、《兔年谈之二:FDA指南更新计划释放行业监管新信号》
作者简介:zhulikou431,高级工程师、PDA会员、ISPE会员、ECA会员、PQRI会员、资深无菌GMP专家,在无菌工艺开发和验证、药品研发和注册、CTD文件撰写和审核、法规审计、国际认证、国际注册、质量体系建设与维护领域,以及无菌检验、环境监控等领域皆具有较深造诣。近几年开始着力关注制药宏观领域趋势分析和制药企业并购项目的风险管理工作。




合作咨询
![]() 肖女士
肖女士
![]() 021-33392297
021-33392297
![]() Kelly.Xiao@imsinoexpo.com
Kelly.Xiao@imsinoexpo.com
 2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57
2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57