2022年国家局通过发布规范、指导原则、管理规定等一系列文件,开启了中药传承创新发展的具体工作,2023年国家局将会通过对中药材、中药饮片、中药配方 颗粒、院内制剂、中药审评、上市管理、中药标准以及安全监管方面的管理,大幅提升中药的监管力度,为中药的创新与传承打下坚实基础。而作为中药药品上市许可持有人、中药材种植单位、中药饮片企业、医疗机构应该时刻关注中药法规的变换,以便通过对国家政策了解,来做好未来5年甚至10年的发展布局。
2023年01月04日 国家局发布了《国家药监局关于印发进一步加强中药科学监管促进中药传承创新发展若干措施的通知》国药监药注〔2023〕1号。
该通知通过对中药材、中药饮片、配方 颗粒、院内制剂、中药审评、中药上市后管理、中药标准、中药安全监管、中药监管全球化及以上制度的保障措施,共计10方面内容。
针对国家局发布的这方面的文章,内容看似空话,没有实际内容,但里面的很多工作,国家局其实已经逐渐展开,未来或许相关内容都将逐步实现。中药材、中药饮片、配方 颗粒、中成药相关机构和单位还需慎重对待,慎重布局未来公司规划。2022年或许就是未来中药变化元年。
①中药材篇:
一、时隔二十年,《中药材生产质量管理规范》再发布!
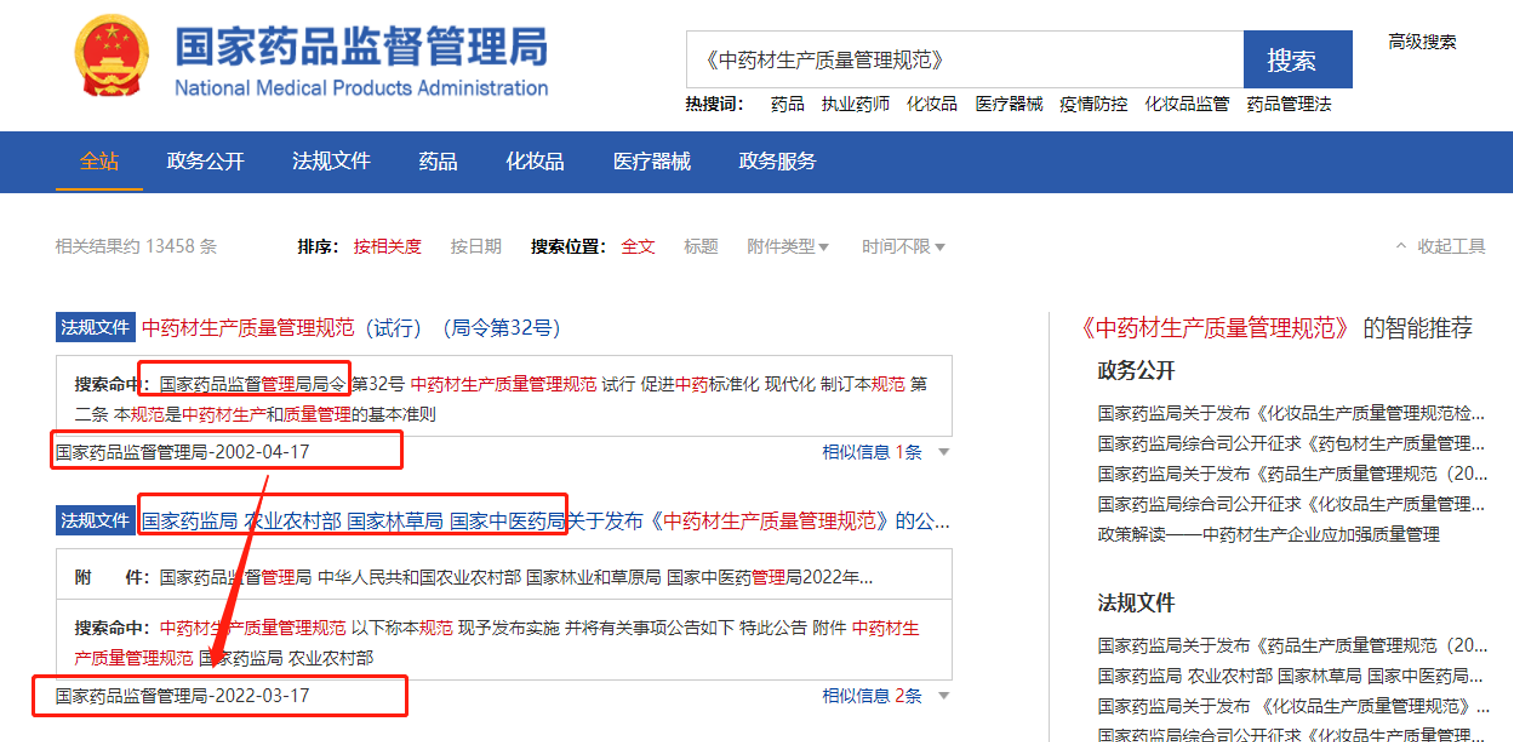
继2002年国家局发布《中药材生产质量管理规范》后,2022年四部门首次联合发布《中药材生产质量管理规范》,以推动中药材规范生产,促进中药材规范化、产业化、规模化种植养殖,推动中药生产企业采取自建、共建、联建或共享中药材种植养殖基地,并提到中药注 射 剂生产所用的中药材,原则上应当符合GAP要求,随后国家局又连续推出相关政策解读。
二、《实施审批管理的中药材品种目录》、《地区性民间习用药材管理办法》后续的颁布和实施
《中华人民共和国药品管理法(2019年修订)》第二十四条和第一百五十三条分别规定如下:
第二十四条:在中国境内上市的药品,应当经国务院药品监督管理部门批准,取得药品注册证书;但是,未实施审批管理的中药材和中药饮片除外。实施审批管理的中药材、中药饮片品种目录由国务院药品监督管理部门会同国务院中医药主管部门制定。
申请药品注册,应当提供真实、充分、可靠的数据、资料和样品,证明药品的安全性、有效性和质量可控性。
第一百五十三条:地区性民间习用药材的管理办法,由国务院药品监督管理部门会同国务院中医药主管部门制定。
三、建设中药材数基本数据库
据2021年国家局统计分析,全年共计抽检203198次,不合格批次948次,其中中药材、中药饮片占据735次,占总不合格的77.53%。
因此,国家局后续准备组织综合分析中药材质量监测数据,关注不同产地中药材质量的差异,研究发布中药材质量监测报告(2023年,我们期待更加具体分析数据),构建涵盖药材品种考证、产地、质量、安全等信息的国家中药材质量基本数据库,促进中药材数据信息的共享和共用。
四、合理增设允许药材进口边境口岸
2022年01月28日,国家局 同意长沙、苏州、无锡、郑州、济南、沈阳、深圳7个药品进口口岸增加进口药材事项。

2022年3月,国家药监局 海关总署增设广西壮族自治区崇左市爱店口岸为药材进口边境口岸。
为持续强化进口药材检验能力建设,提升进口药材质量追溯水平。2023年会继续合理增设允许药品进口的口岸或允许药材进口的边境口岸。
②中药饮片、中药配方 颗粒篇
一、2023年可能会制定《实施审批管理的中药饮片目录》及配套文件
2023年国家中医药管理局制定《实施审批管理的中药饮片目录》及配套文件,依法对符合规定情形的中药饮片实施审批管理。
二、持续优化《国家中药饮片炮制规范》
2022年12月30日,国家局发布关于实施《国家中药饮片炮制规范》有关事项的公告(2022年第118号)。
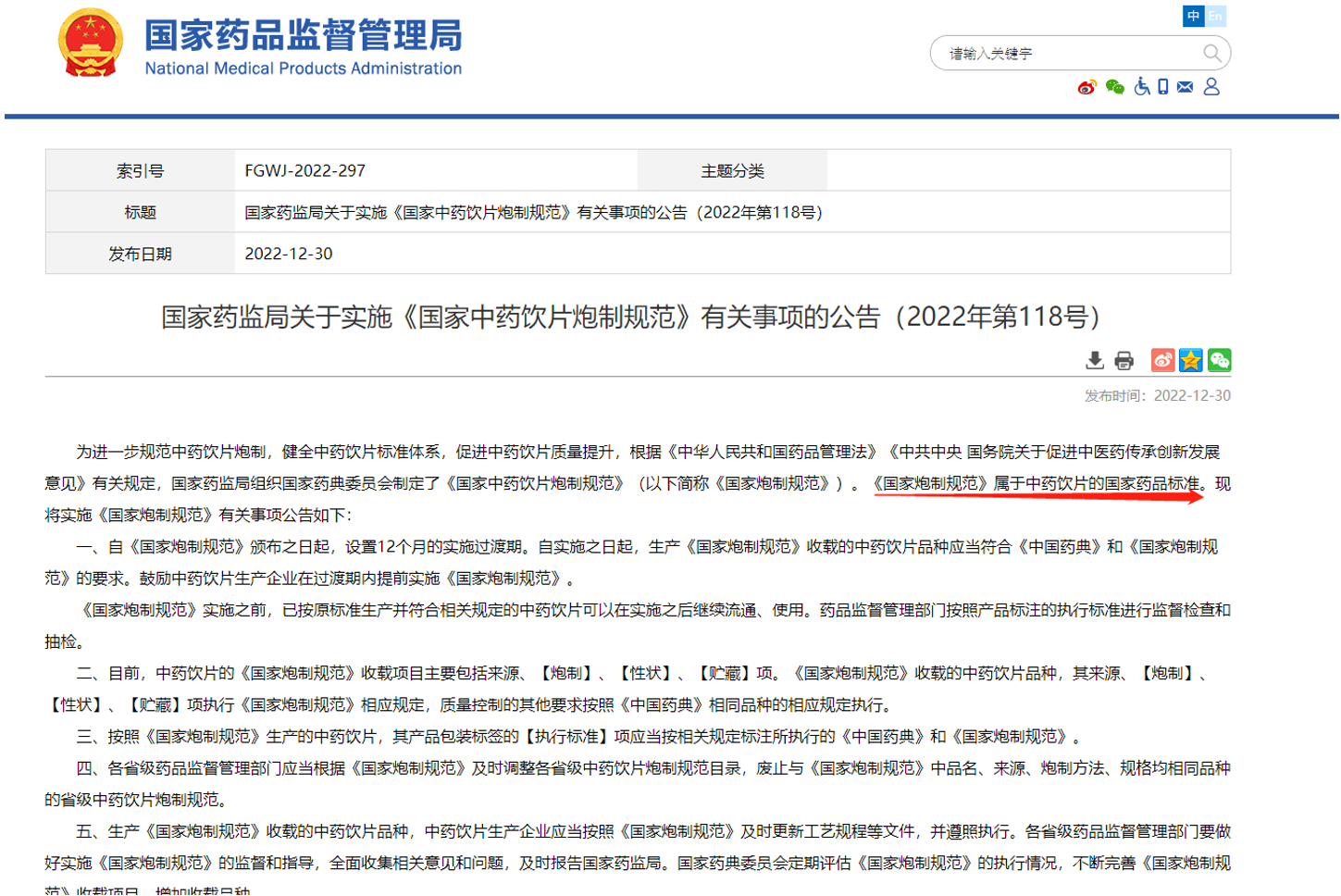
该通知规定了自12月30日起,具有为期1年的过渡期,并规定了过渡期内具体执行要求,以及《国家中药饮片炮制规范》与各省炮制规范的具体关系,值得所有相关企业关注该方面内容。
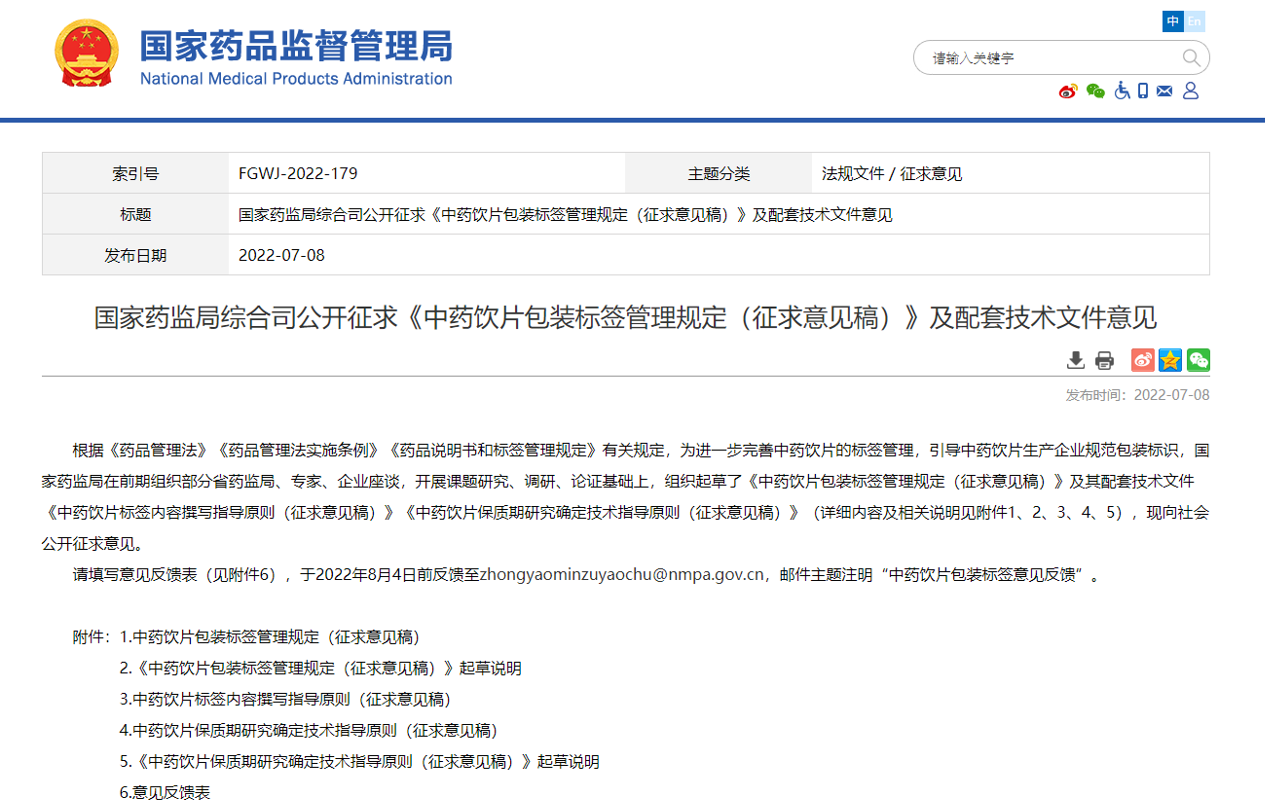
三、中药饮片开启体系追溯
2022年07月08日,国家药监局综合司公开征求《中药饮片包装标签管理规定(征求意见稿)》及配套技术文件意见。具体征求了《中药饮片包装标签管理规定(征求意见稿)》、《中药饮片标签内容撰写指导原则(征求意见稿)》、《中药饮片保质期研究确定技术指导原则(征求意见稿)》,2023年以上文件可能会正式实施,来规范中药饮片标签的标识内容。
四、中药饮片开启三化模式生产
2023年国家会引导和督促中药饮片生产企业结合产业规划、资源优势、技术能力等生产实际,优化调整品种生产结构,逐步推进实现中药饮片集约化、精品化、规模化的生产模式。
③院内制剂篇
一、积极推进院内制剂向新药转化
推动医疗机构采用大数据、人工智能、真实世界研究等技术手段,围绕临床定位、适用人群、用法用量、疗程以及体现中药作用特点和优势的评价指标等对医疗机构中药制剂开展研究。发挥人用经验对医疗机构中药制剂的安全性、有效性的支持作用,支持将疗效确切、特色优势明显,不良反应少的医疗机构中药制剂品种向新药转化。
二、规范调剂使用,加强过程监管
严格按照规定开展医疗机构应用传统工艺配制中药制剂的备案管理工作,及时对已备案的医疗机构 制剂进行资料核查和现场检查,必要时按照相关规定开展抽样检验。规范调剂使用医疗机构中药制剂,支持通过调剂在不同医疗机构内开展多中心临床研究。省级药品监督管理部门参照《药品生产质量管理规范》等相关规定,规范和加强医疗机构中药制剂区域配制车间监管,严格监管其配制中药制剂的质量。
三、加强院内制剂不良反应监测
推动医疗机构建立和完善药物警戒体系,主动开展对医疗机构中药制剂疑似不良反应的监测、识别、评估和控制,必要时对医疗机构中药制剂的有效性、安全性开展研究和综合评价,对疗效不确切、不良反应大或者其他原因危害人体健康的,主动向所在地省级药品监督管理部门申请注销有关批准证明文件或注销备案。
④中药审评篇
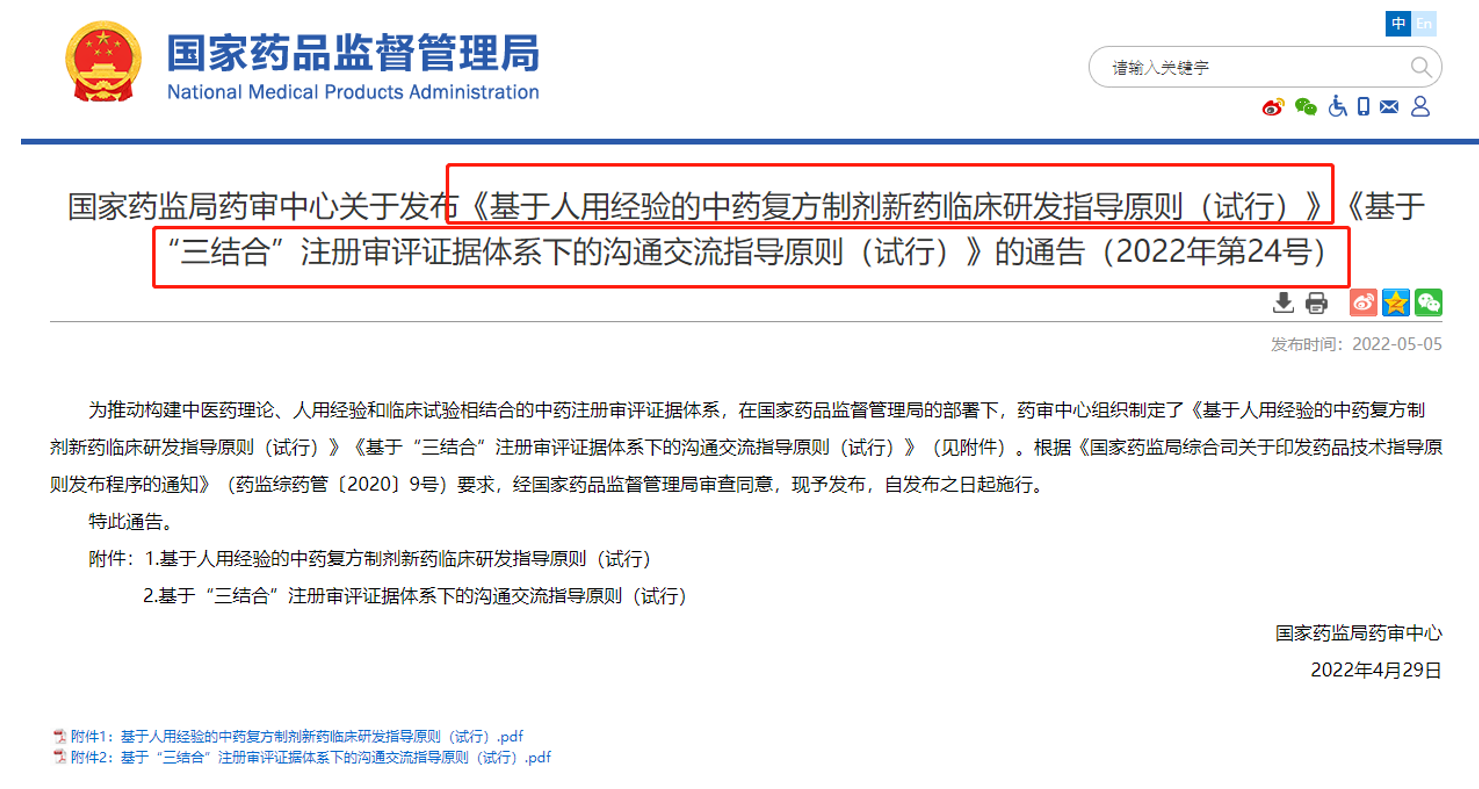
一、"三结合"审评证据体系建设
2022年5月国家局发布了《基于人用经验的中药复方制剂新药临床研发指导原则(试行)》、《基于"三结合"注册审评证据体系下的沟通交流指导原则(试行)》的通告。后续中药审评主要结合中医药理论、人用经验、临床试验三方面作为审评证据体系。
二、应急审批程序趋于逐渐完善阶段
基于中医药在新冠肺炎治疗的临床实践,就当前新冠病毒感染不同阶段的临床表现和中医临床治疗需求,及中药治疗新冠病毒感染的临床优势、作用特点和疗效评价要求等,国家将持续扶持中药新药的研发,加速审批过程,对重大疾病、罕见病、儿童用药、疫情防控等新药将会优先审评。
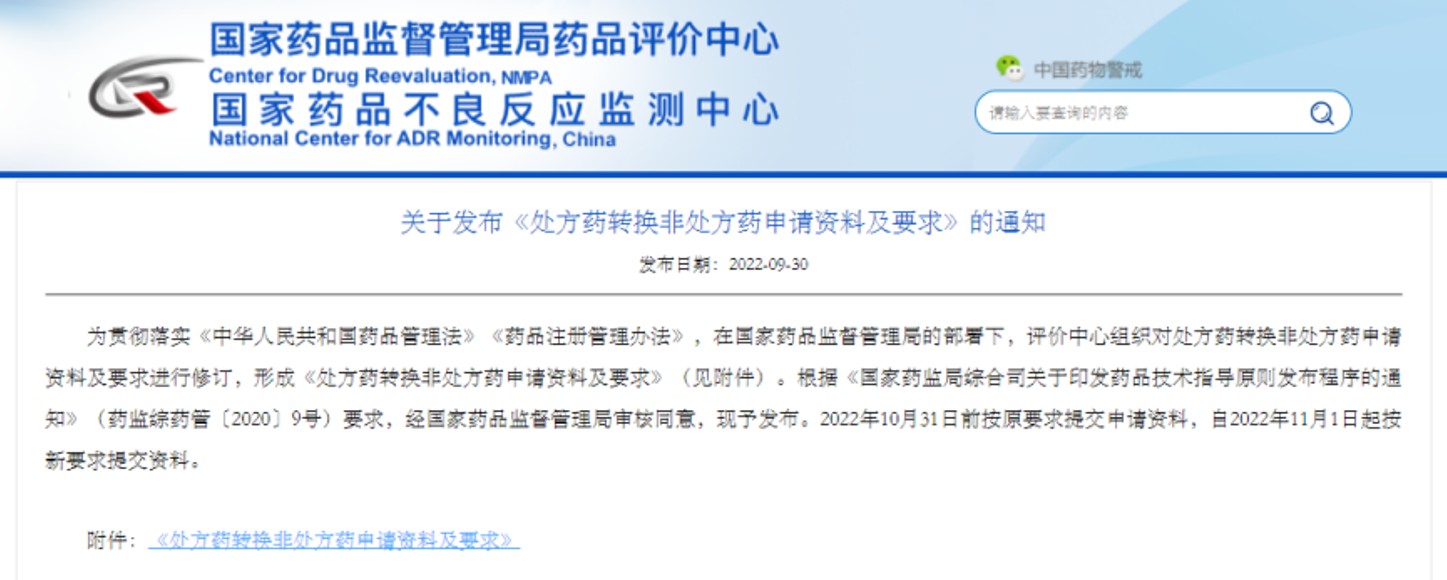
三、处转非注册要求优化
2022年9月30日,国家药品评价中心发布了《处方药转换非处方药申请资料及要求》,该要求自2022年11月1日起实施,从新版申报资料内容反应的趋势来看,新版目前更加注重药品的安全性方面的内容。
⑤上市管理篇
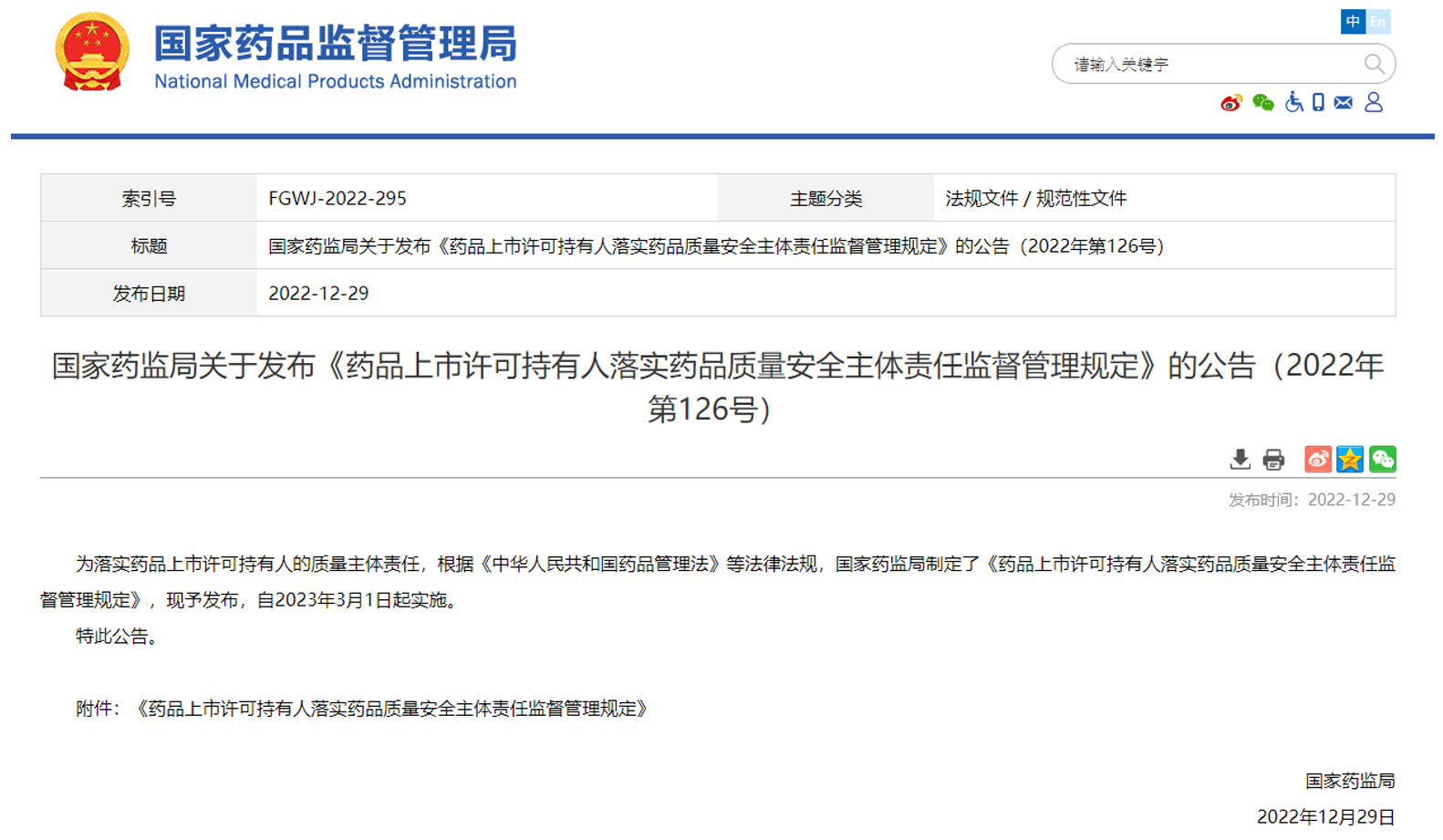
一、完善管理工作机制
2022年12月29日,国家药监局发布了《药品上市许可持有人落实药品质量安全主体责任监督管理规定》,对药品上市许可持有人的相关职责做了明确要求。
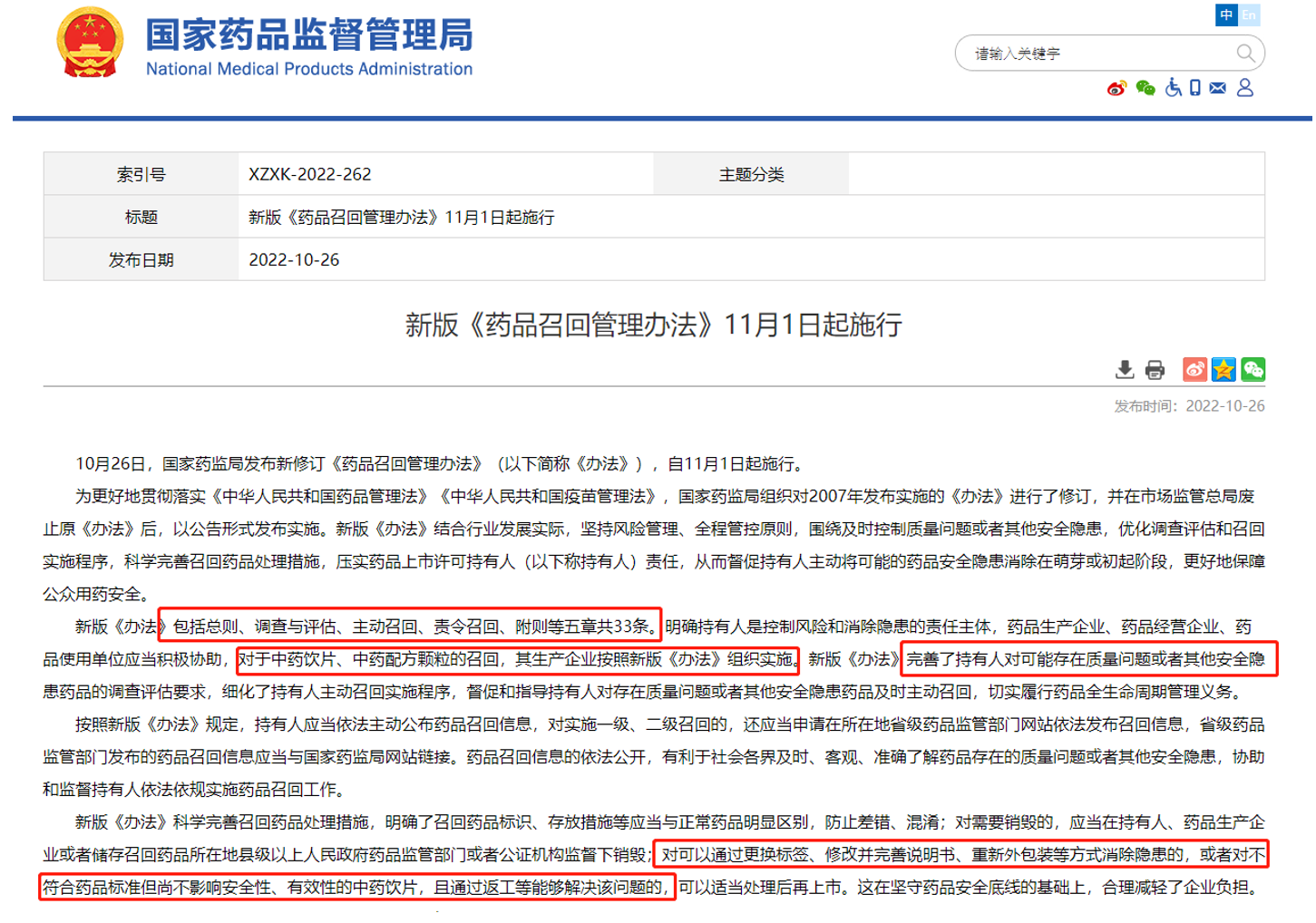
2022年10月26日,国家药监局发布了新版《药品召回管理办法》,并于11月1日起施行。
二、加强变更,强化持有人主题责任意识
2022年发布的《药品上市许可持有人落实药品质量安全主体责任监督管理规定》将于2023年3月1号实行,强化药品上市许可持有人主动提升中药质量的主体责任意识,发挥末端政策发力优势,提升药品上市许可持有人对产品的全生命周期管理能力。对于变更后续或将进行更加细致的等级划分标准。
三、加强不良反应监测
2023年国家局将组织研究开发符合中药特点的中药不良反应信号监测工具,加强不良反应聚集性事件的监测和处置力度。
⑥中药标准篇
一、优化标准管理
2022年12月14日,国家局发布了《药品标准管理办法(征求意见稿)》,征求结束时间为2023年1月14日。
2023年国家局将会研究制定中药标准的管理专门规定,与修订《中国药典》一部相结合,将科学、成熟、适用的中药相关注册标准、国际标准、团体标准或企业内控标准等转化为国家标准。并将建立中药国家标准快速修订机制和修订程序。
二、完善标准内容
2022年药典委发布了252个标准草案公示,2023年国家局将持续推进标准的制定与修订。对于国家中药饮片炮制规范、中药配方 颗粒标准的发布也将加快速度。对于中药农药残留、重金属、真菌素、生长调节剂等限量的要求和检测方法将会设置。对内源性毒 性成分检测研究也会加强,后续也将会制定相应的限度标准和用法用量。
三、中药标准数字化管理
2023年,国家局将建立标准动态数据库,推进数字化标准建设,实现药品标准的发布、查询、分析、研究、维护信息化。
⑦安全监管篇
一、"网格化"管理,制定《中药生产质量管理规范》
2023年国家局将构建"网格化"监管模式,并会研究、制定、监督实施《中药生产质量管理规范》,将会实施生产区域化风险的研判机制,针对重点企业、重点品种、重点环节,持续加强中药饮片、中药配方 颗粒和中成药监督检查,有序开展中药材延伸检查。并将会对使用环节进行加强质量监管。
二、质量抽检
科学开展探索性研究,对抽检数据综合分析、优化结果发布机制。
⑧总结
2022年主要事件汇总:
● 《中药材生产质量管理规范》
● 《地区性民间习用药材管理办法》
● 增加8个药材进口边境口岸
● 《中药饮片包装标签管理规定(征求意见稿)》
● 《中药饮片标签内容撰写指导原则(征求意见稿)》
● 《中药饮片保质期研究确定技术指导原则(征求意见稿)》
● 《基于人用经验的中药复方制剂新药临床研发指导原则(试行)》
● 《基于"三结合"注册审评证据体系下的沟通交流指导原则(试行)》
● 《处方药转换非处方药申请资料及要求》
● 《药品上市许可持有人落实药品质量安全主体责任监督管理规定》
● 《药品召回管理办法》
● 《药品标准管理办法(征求意见稿)》
● 《中药注册管理专门规定》(征求意见稿)
● 2023年可能事件预测:
● 《实施审批管理的中药材品种目录》
● 建立中药材基本数据库
● 继续增加药材进口边境口岸
● 《国家中药饮片炮制规范》第1批公示,后续会持续发布第2、3……批。
● 中药标准动态数据库
● 《中药生产质量管理规范》(征求意见稿及试行)
● 《中药饮片包装标签管理规定(试行)》
● 《中药饮片标签内容撰写指导原则(试行)》
● 《中药饮片保质期研究确定技术指导原则(试行)》
● 《药品标准管理办法(试行)》
● 《中药注册管理专门规定》(试行)
● 《中药标准管理专门规定》(征求意见稿及试行)



合作咨询
![]() 肖女士
肖女士
![]() 021-33392297
021-33392297
![]() Kelly.Xiao@imsinoexpo.com
Kelly.Xiao@imsinoexpo.com
 2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57
2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57