自2021年《药物警戒质量管理规范》(简称GVP)实施以来,药物警戒工作逐渐步入规范化、系统化的轨道。2024年,该规范的实施得到了进一步的加强和落实,为药物警戒工作的质量提供了坚实的保障。随着药品安全监管的不断加强,药物警戒作为保障公众用药安全的重要环节,受到了前所未有的重视。各地药监局相继发布了关于进一步做好药物警戒工作的通知,如山西省和海南省的药监局分别发布了相关通知,强调了药物警戒工作的重要性,并提供了具体的指导和要求。鉴于医药界同仁对各省局药物警戒配套政策动态的广泛关注,笔者整理并分析了截至2024年12月底,自《药物警戒质量管理规范》于2021年12月1日全面施行以来,国内主要省市陆续发布的与之配套的重要工作指导文件及实施指南。这些文件不仅细化了药物警戒管理的操作流程,还为业界提供了更加清晰、透明的政策导向,旨在推动药品产业的高质量发展。如有遗漏之处,欢迎各位读者积极留言补充,共同完善这一盘点。
一、各省市药物警戒配套政策发布概况
中国大陆31个省市自治区地方药监局的排序依据是按照1949年新中国成立时设立的六大行政区域进行的,具体大区名称及编号分别为:华北(1)、东北(2)、华东(3)、中南(4)、西南(5)、西北(6)。截至2024年12月31日,全国31个省级行政区(含23个省、5个自治区、4个直辖市)中,已有21个省市完成了药物警戒配套政策的发布工作,占比达67.7%,其余10个省市的药监局尚未发布相关配套政策。这些配套政策的出台,不仅为药物警戒工作指明了方向,还详细规划了具体任务和时间安排,为该项工作的深入实施奠定了坚实的政策基础。各省市药物警戒配套政策发布情况如下表:
各省市药物警戒配套政策发布情况
|
大区归属 |
省份 |
简称 |
是否有涉及药物警戒配套政策的发布 |
|
华北大区 |
北京 |
京 |
有 |
|
天津 |
津 |
有 |
|
|
河北 |
冀 |
有 |
|
|
山西 |
晋 |
有 |
|
|
内蒙古 |
蒙 |
/ |
|
|
东北大区 |
辽宁 |
辽 |
有 |
|
吉林 |
吉 |
/ |
|
|
黑龙江 |
黑 |
有 |
|
|
华东大区 |
上海 |
沪 |
有 |
|
江苏 |
苏 |
有 |
|
|
浙江 |
浙 |
有 |
|
|
安徽 |
皖 |
有 |
|
|
福建 |
闽 |
/ |
|
|
江西 |
赣 |
有 |
|
|
山东 |
鲁 |
有 |
|
|
中南大区 |
河南 |
豫 |
有 |
|
湖北 |
鄂 |
有 |
|
|
湖南 |
湘 |
/ |
|
|
广东 |
粤 |
有 |
|
|
广西 |
桂 |
有 |
|
|
海南 |
琼 |
有 |
|
|
西南大区 |
重庆 |
渝 |
/ |
|
四川 |
川 |
有 |
|
|
贵州 |
黔 |
/ |
|
|
云南 |
滇 |
/ |
|
|
西藏 |
藏 |
有 |
|
|
西北大区 |
陕西 |
陕 |
有 |
|
甘肃 |
甘 |
有 |
|
|
青海 |
青 |
/ |
|
|
宁夏 |
宁 |
/ |
|
|
新疆 |
新 |
/ |
二、全国各省局药物警戒相关配套文件发布概况
为便于制药行业从业者,特别是负责药物警戒的专业人士能够迅速、准确地掌握本省关于药品药物警戒的最新政策动态,笔者特地对截至2024年12月31日的全国31个省级药品监督管理局发布的所有相关配套政策进行了全面汇总与分析。
(1) 根据最新的统计分析,中国大陆六大行政区发布的药品药物警戒相关配套政策数量如下:东北大区2个、华北大区7个、华东大区23个、西北大区3个、西南大区2个、中南大区12个。其中,华东大区以23个政策文件的数量领先于其他大区,显示出该地区在药品药物警戒管理方面的积极作为和政策创新力度。此外,山东省药监局在政策发布方面表现突出,共发布了13个相关政策法规,位居全国各省局之首。
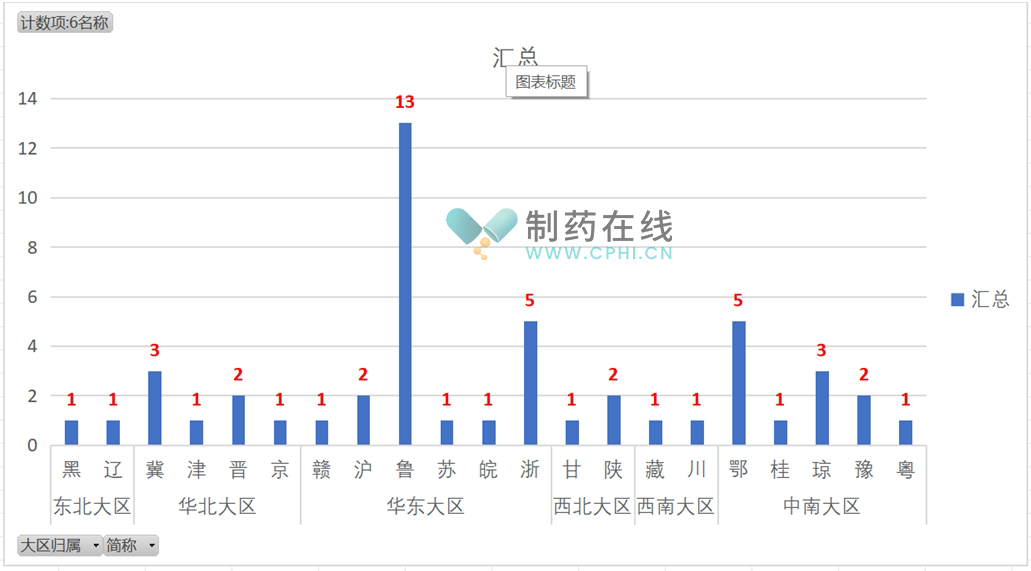
(2) 全国31个省局已累计发布49个政策法规,已正式落地实施48个,还有1个处于征求意见稿,发布2年还未定稿,陕西局需要加油,如下表:
|
药品监管机构 |
发布日期 |
政策名称 |
状态 |
|
陕西省药品监督管理局 |
2022-08-26 |
《陕西省药物警戒检查指导细则(征求意见稿)》 |
征求意见稿 |
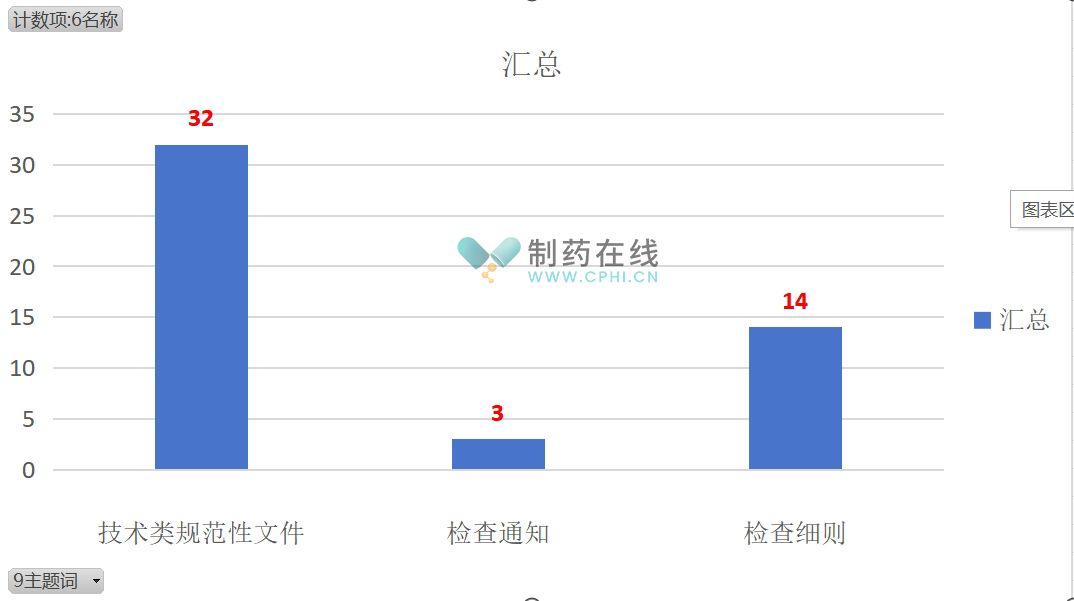
(3) 全国31个省局已发布的药品药物警戒相关配套文件(含征求意见稿),累计49个政策法规,包括"技术类规范性文件" 32个、"检查通知"个 3、"检查细则" 14个。
三、全国各省局药物警戒相关配套文件发布清单
为了全面贯彻落实《中华人民共和国药品管理法》、《中华人民共和国疫苗管理法》、《药物警戒质量管理规范》及《药物警戒检查指导原则》等关键法律法规,全国多个省市的药监管理部门积极响应,结合当地实际情况,制定并发布了各具特色的区域性药物警戒管理办法和工作指南。这些政策文件旨在进一步规范和指导药物警戒工作的深入实施。
为方便制药人,尤其是注册人随时方便查阅本省有关药物警戒管理政策,笔者汇总了截至2024年12月底的配套政策清单,如有遗漏,欢迎大家补充,按照检查细则、技术类规范性文件、检查通知3大类别分别展示。
1.检查细则14个(已实施13个,征求意见稿1个)
近年来,各省市药品监督管理部门积极出台了一系列药物警戒相关政策,以规范和指导药品上市许可持有人的药物警戒工作。例如,北京市、天津市和河北省联合发布了《京津冀药品上市许可持有人药物警戒质量管理规范操作指南(试行)》,按三省局分别发布的政策进行统计,旨在指导京津冀地区药品上市许可持有人规范开展药物警戒工作,促进GVP在该区域的落地实施。此外,山西省发布了《药物警戒检查细则(试行)》,辽宁省制定了《药物警戒检查管理规范》,江苏省发布了《江苏省药品上市许可持有人药物警戒质量管理规范实操指南(试行)》,浙江省出台了《浙江省严重药品不良事件现场检查工作指南》和《浙江省药物警戒检查要点(试行)》,湖北省制定了《湖北省药物警戒质量管理规范实操指引》,广西壮族自治区发布了《广西壮族自治区药物警戒检查指南(试行)》,海南省发布了《海南省药物警戒检查要点(试行)》,四川省发布了《四川省药物警戒检查要点》,甘肃省发布了《甘肃省药物警戒质量管理规范操作技术指南(试行)》,陕西省发布了《陕西省药物警戒检查指导细则(征求意见稿)》。这些政策文件为各地药品上市许可持有人提供了详细的指导,帮助其更好地履行药物警戒职责,确保药品的安全性和有效性。
|
发布机构 |
发布日期 |
文号 |
政策名称 |
政策相关链接 |
政策状态 |
|
北京市药品监督管理局 |
2024/03/07 |
冀药监〔2024〕号 |
《京津冀药品上市许可持有人药物警戒质量管理规范操作指南(试行)》 |
http://yjj.hebei.gov.cn/hbpda/xxgk/zfxxgk/zhce/ztfl/hyjg/20240307094910194.html |
已实施 |
|
天津市药品监督管理局 |
|||||
|
河北省药品监督管理局 |
|||||
|
山西省药品监督管理局 |
2023/03/07 |
晋药监规〔2023〕1号 |
《药物警戒检查细则(试行)》 |
http://yjj.shanxi.gov.cn/xxfb/wjtz/202303/t20230307_8106954.shtml |
已实施 |
|
辽宁省药品监督管理局 |
2024/05/30 |
/ |
DB21/T3972—2024《药物警戒检查管理规范》 |
https://scjg.ln.gov.cn/scjdglj/hd/zjdc/2024052014091742666/2024052014082289748.pdf |
已实施 |
|
江苏省药品监督管理局 |
2023/01/28 |
/ |
《江苏省药品上市许可持有人药物警戒质量管理规范实操指南(试行)》 |
http://da.jiangsu.gov.cn/art/2023/1/28/art_84627_10734528.html |
已实施 |
|
浙江省药品监督管理局 |
2021/12/31 |
浙药监规〔2021〕5号 |
《浙江省严重药品不良事件现场检查工作指南》 |
http://mpa.zj.gov.cn/art/2021/12/31/art_1229136205_2387716.html |
已实施 |
|
浙江省药品化妆品审评中心 |
2024/08/02 |
/ |
《浙江省药物警戒检查要点(试行)》 |
https://mpa.zj.gov.cn/art/2024/8/2/art_1228989285_58937422.html |
已实施 |
|
湖北省药品监督管理局 |
2023/02/09 |
/ |
《湖北省药物警戒质量管理规范实操指引》 |
相关附件暂未在网上公布 |
已实施 |
|
广西壮族自治区药品监督管理局 |
2022/10/26 |
/ |
《广西壮族自治区药物警戒检查指南(试行)》 |
已实施 |
|
|
海南省药品监督管理局 |
2022/06/17 |
/ |
《海南省药物警戒检查要点(试行)》 |
https://amr.hainan.gov.cn/himpa/xxgk/zcwjk/202212/t20221207_3324656.html |
已实施 |
|
四川省食品药品审查评价及安全监测中心 |
2022/07/26 |
/ |
《四川省药物警戒检查要点》 |
已实施 |
|
|
甘肃省药品监督管理局 |
2023/07/27 |
/ |
《甘肃省药物警戒质量管理规范操作技术指南(试行)》 |
http://yjj.gansu.gov.cn/yjj/c114406/202308/169922504.shtml |
已实施 |
|
陕西省药品监督管理局 |
2022-08-26-0905 |
陕药监函〔2022〕272号 |
《陕西省药物警戒检查指导细则(征求意见稿)》 |
征求意见稿 |
2.技术类规范性文件32个(已实施32个)
近年来,各省市药品监督管理部门及相关机构积极出台了一系列药物警戒相关政策,以规范和指导药品不良反应监测与药物警戒工作。例如,河北省发布了《药品不良反应快速报告导则》和《河北省药品不良反应/事件死亡病例调查工作指南(试行)》,黑龙江省制定了《药物警戒质量管理规范实施细则》,安徽省明确了《药品上市许可持有人药物警戒(上市后)主体责任清单》,上海市出台了《药物警戒管理办法(试行)》和《药物警戒活动委托质量管理规范》等。此外,浙江省、河南省、湖北省、广东省、海南省、陕西省、山东省、西藏自治区等地也分别发布了关于药物警戒信息化系统建设、严重药品不良事件调查、药品上市后风险管理、药物警戒服务外包、药物警戒安全性信号分析、中药药物警戒、医疗机构药品不良反应监测等方面的规范和指南,旨在提高药物警戒工作的科学性、规范性和有效性,保障公众用药安全。
|
发布机构 |
发布日期 |
文号 |
政策名称 |
政策相关链接 |
政策状态 |
|
河北省市场监督管理局 |
2022/02/28 |
/ |
DB13/T5482—2022《药品不良反应快速报告导则》 |
http://yjj.hebei.gov.cn/directory/web/hbpda/xwdt/zxdt/20220419091410103.html |
已实施 |
|
河北省药品不良反应监测中心 |
2012/01/11 |
/ |
河北省药品不良反应/事件死亡病例调查工作指南(试行) |
https://yjj.hebei.gov.cn/directory/web/hbpda/xxgk/xzzfgs/sqgk/20120111974197629.html |
已实施 |
|
黑龙江省药品监督管理局 |
2022/12/30 |
黑药监规〔2022〕19号 |
《黑龙江省药物警戒质量管理规范实施细则》 |
已实施 |
|
|
安徽省药品监督管理局 |
2023/12/15 |
/ |
《安徽省药品上市许可持有人药物警戒(上市后)主体责任清单》 |
已实施 |
|
|
上海市药品监督管理局 |
2024/06/24 |
沪药监规〔2024〕4号 |
上海市药物警戒管理办法(试行)》 |
https://yjj.sh.gov.cn/zx-yp/20240624/4fe7096d4b9c4c868a802e1ef8de00d3.html |
已实施 |
|
上海医药行业协会 |
2023/12/25 |
沪医协(2023)办字第053号 |
T/SHPPA024—2023《药物警戒活动委托质量管理规范》 |
已实施 |
|
|
浙江省软件行业协会 |
2023/12/05 |
/ |
T/ZSIA0003—2023《药物警戒信息化系统建设与运营规范》 |
已实施 |
|
|
浙江省药品监督管理局 |
2021/12/31 |
浙药监规〔2021〕5号 |
《浙江省严重药品不良事件临床调查工作指南》 |
http://mpa.zj.gov.cn/art/2021/12/31/art_1229136205_2387716.html |
已实施 |
|
浙江省药品监督管理局 |
2021/12/31 |
浙药监规〔2021〕5号 |
《浙江省药品上市许可持有人预防和处理严重药品不良事件指南》 |
http://mpa.zj.gov.cn/art/2021/12/31/art_1229136205_2387716.html |
已实施 |
|
河南省药学会 |
2024/4/2 |
/ |
T/HENANPA 012—2024《国家药品不良反应监测系统个例报告信息上报规范》 |
已实施 |
|
|
河南省药学会 |
2024/4/2 |
/ |
T/HENANPA 013—2024《药品不良反应/事件关联性评价规范》 |
已实施 |
|
|
湖北省药品监督管理局 |
2014/12/26 |
/ |
《湖北省药品不良反应聚集性事件预警信号调查处理规程》 |
https://mpa.hubei.gov.cn/zfxxgk/zc/qtzdgkwj/201412/t20141226_3046165.shtml |
已实施 |
|
湖北省药品监督管理局 |
2021/09/13 |
/ |
《湖北省药品不良反应聚集性事件监测处置工作程序》 |
https://mpa.hubei.gov.cn/bmdt/dtyw/202109/t20210913_3753780.shtml |
已实施 |
|
湖北省药品监督管理局 |
2024/12/26 |
(2024年第12号) |
《湖北省药品上市后风险管理计划撰写指南》 |
https://mpa.hubei.gov.cn/zfxxgk/zc/qtzdgkwj/qtwj/202412/t20241226_5475470.shtml |
已实施 |
|
湖北省药品监督管理局 |
2024/12/26 |
(2024年第13号) |
《药品质量安全双向预警管理指南》 |
https://mpa.hubei.gov.cn/zfxxgk/zc/qtzdgkwj/qtwj/202412/t20241226_5475478.shtml |
已实施 |
|
广东省药学会 |
2024/05/09 |
/ |
T/GDPA2-2024《药物警戒服务外包管理规范》 |
已实施 |
|
|
海南省药品监督管理局 |
2023/08/08 |
/ |
《基于自发报告系统的海南省药物警戒安全性信号分析工作指南》 |
相关附件暂未在网上公布 |
已实施 |
|
陕西省药品监督管理局 |
2020/10/28 |
陕药监办发〔2020〕119号 |
《陕西省药物警戒协同工作机制实施意见(试行)》 |
已实施 |
|
|
山东省药品监督管理局 |
2022/05/31 |
/ |
《山东省药品上市许可持有人药物警戒制度规程撰写指南(试行)》 |
相关附件暂未在网上公布 |
已实施 |
|
山东省药品监督管理局 |
2021/08/23 |
/ |
《山东省药品上市后风险管理计划撰写指南》 |
http://mpa.shandong.gov.cn/art/2021/8/25/art_334995_15407.html |
已实施 |
|
山东省药品监督管理局 |
2022年4月 |
/ |
《药物警戒相关法律法规文件汇编》 |
相关附件暂未在网上公布 |
已实施 |
|
山东省药品监督管理局 |
2024/4/23 |
/ |
《山东省中药不良反应对应MedDRA术语词表(第一批)》 |
http://mpa.shandong.gov.cn/art/2024/4/23/art_114725_10387230.html |
已实施 |
|
山东省药品监督管理局 |
2024/3/26 |
2024年第5号 |
《山东省药品上市许可持有人主动开展已上市中药说明书安全信息修订操作指南》 |
http://mpa.shandong.gov.cn/art/2024/3/26/art_101747_10382462.html |
已实施 |
|
山东省药品监督管理局 |
2012/07/25 |
鲁药监测函﹝2012〕41号 |
《山东省药品不良反应/事件死亡病例调查工作指南(试行)》 |
相关附件暂未在网上公布 |
已实施 |
|
山东省药品不良反应监测中心 |
2024/12/10 |
/ |
《山东省药品上市许可持有人中药药物警戒质量管理规范实施指南》 |
http://mpa.shandong.gov.cn/art/2024/12/10/art_114725_10405567.html |
已实施 |
|
山东省药品不良反应监测中心 |
2024/12/10 |
/ |
《山东省药品上市许可持有人信号检测与评价操作技术指南》 |
https://mpa.shandong.gov.cn/art/2024/12/10/art_114725_10405566.html |
已实施 |
|
山东省药品不良反应监测中心 |
2024/12/10 |
/ |
《山东省药品上市许可持有人主动开展已上市中药说明书安全信息修订操作指南》 |
http://mpa.shandong.gov.cn/art/2024/12/10/art_114725_10405564.html |
已实施 |
|
山东省药品不良反应监测中心 |
2024/12/10 |
/ |
《山东省中药不良反应对应MedDRA术语词表(第一批)》 |
http://mpa.shandong.gov.cn/art/2024/12/10/art_114725_10405563.html |
已实施 |
|
山东省药品不良反应监测中心 |
2024/12/10 |
/ |
《山东省药品上市许可持有人药物警戒内部审核工作指南》 |
http://mpa.shandong.gov.cn/art/2024/12/10/art_114725_10405562.html |
已实施 |
|
山东省药品不良反应监测中心 |
2024/12/10 |
/ |
《山东省药品上市许可持有人已上市中药安全性分析报告撰写指南(试行)》 |
http://mpa.shandong.gov.cn/art/2024/12/10/art_114725_10405561.html |
已实施 |
|
山东省药品监督管理局 山东省卫生健康委员会 |
2024/12/13 |
2024年第25号 |
《山东省医疗机构药品不良反应监测技术指南》 |
http://mpa.shandong.gov.cn/art/2024/12/13/art_101747_10406002.html |
已实施 |
|
西藏自治区药品监督管理局 |
2024/11/08 |
/ |
《西藏自治区药品不良反应监测哨点管理办法》 |
https://mpa.xizang.gov.cn/zwgk/gsgg/qtggtg/202411/t20241108_446172.html |
已实施 |
3.检查通知3个(已实施3个)
在2024年,山西省、江西省和海南省的药品监督管理局分别发布了药物警戒相关通知,以加强药物警戒工作。这些政策旨在规范和指导药品上市许可持有人和相关企业加强药物警戒管理,确保药品安全,保障公众健康。
|
发布机构 |
发布日期 |
文号 |
政策名称 |
政策相关链接 |
政策状态 |
|
山西省药品监督管理局 |
2024/05/16 |
/ |
《山西省药品监督管理局关于开展2024年药物警戒专项检查的通知》 |
http://yjj.shanxi.gov.cn/xxfb/wjtz/202405/t20240516_9562352.shtml |
已实施 |
|
江西省药品监督管理局 |
2024/03/20 |
赣药监药品生产〔2024〕12号 |
《江西省药品监督管理局关于开展2024年药物警戒检查的通知》 |
http://mpa.jiangxi.gov.cn/art/2024/3/20/art_37110_4819682.html |
已实施 |
|
海南省药品监督管理局 |
2024/03/08 |
琼药监注产〔2024〕45号 |
《关于进一步做好2024年药品上市许可持有人药物警戒工作的通知》 |
书面通知 |
已实施 |
参考文献
[1] 各省药品监督管理局网站



合作咨询
![]() 肖女士
肖女士
![]() 021-33392297
021-33392297
![]() Kelly.Xiao@imsinoexpo.com
Kelly.Xiao@imsinoexpo.com
 2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57
2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57