偏差管理在药品质量风险管理中占据核心地位,也是药品委托生产现场检查的关键环节。MAH制度的推行,作为我国药品监管体系的重大革新,自2019年12月1日新版《中华人民共和国药品管理法》实施起,正式在全国范围内落地。随后,2020年7月1日施行的新版《药品注册管理办法》及《药品生产监督管理办法》等法规,进一步细化了MAH制度的框架、适用范围、资质标准及法律责任。针对如何构建符合中国法规的偏差管理体系,笔者依据国家及地方药监局的指导文件,系统梳理了药品委托生产现场检查中的偏差管理实施要点,供制药行业同仁参阅,期待指正完善。
一、GMP关于偏差管理的关注要点
GMP规定了一套严格的生产和质量控制标准,以确保药品的安全性、有效性和质量。在这一框架下,偏差管理成为一个关键环节,它涉及到对生产过程中任何偏离预定标准或程序的识别、记录、调查和处理。根据2010年GMP要求,以下是搭建偏差管理体系的关注要点主要包括:
(1)建立SOP:企业需制定偏差处理的操作规程,涵盖报告、记录、调查、处理及纠正措施,并保留相关记录。
(2)评估偏差影响:任何偏差都需评估其对产品质量的潜在影响。对于重大偏差,还需考虑是否需要额外检验、对有效期的影响,并可能需要进行稳定性考察。
(3)记录与报告:所有偏差都应记录,并立即报告给部门主管,以确保控制偏差。质量部门需对偏差进行分类、调查,并形成调查报告,特别是对于重大偏差。
(4)风险评估:评估偏差对产品质量的影响。若产品质量未受影响,需记录解释;若影响不明确,则需进行根本原因调查、风险评估,并启动纠正预防系统。
(5)记录纠偏行动:纠偏行动和预防措施完成后,应及时记录,并形成偏差报告,由质量受权人批准,确认纠偏和预防措施的执行情况,并关闭偏差。
(6)偏差档案管理:质量管理部门负责偏差的分类、调查、处理,记录和报告的整理归档。
二、偏差管理的实施过程的现场检查关注要点
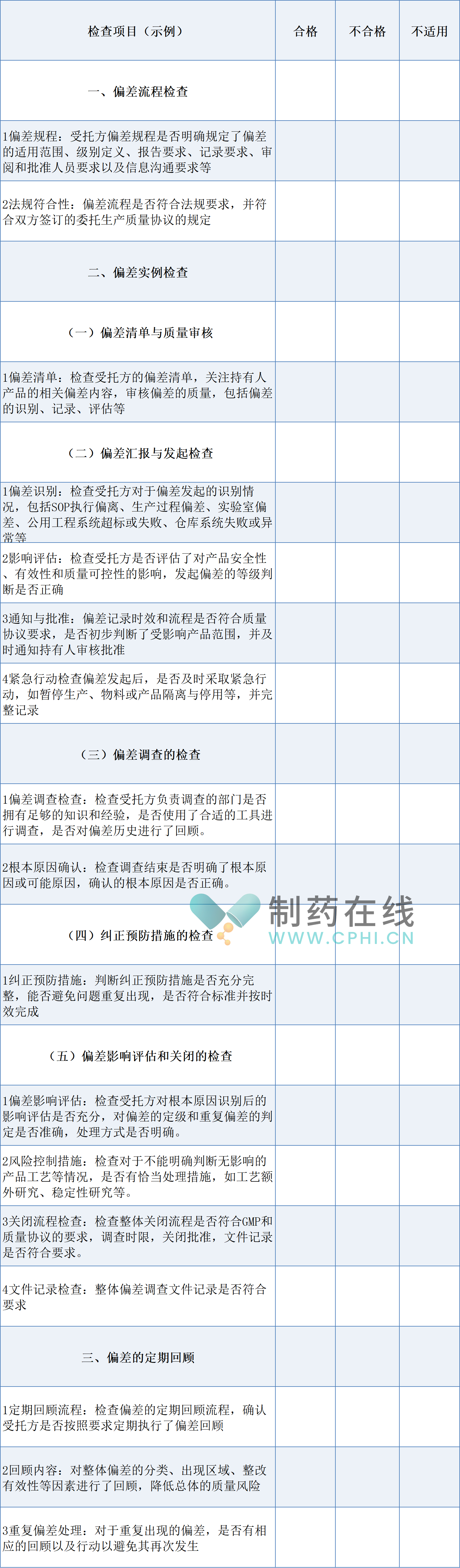
委托生产中偏差管理的难点在于包括但不限于。首先,需确保受托方的偏差规程详尽且合规,涵盖偏差的识别、报告、调查、纠正预防及关闭等各个环节,并与双方签订的质量协议保持一致。其次,偏差实例的检查复杂且繁琐,需细致审查偏差清单,评估偏差对产品的影响,并确认紧急行动是否及时有效。此外,偏差调查的专业性和严谨性至关重要,需确保调查部门具备足够的知识和经验,使用合适的工具和方法,找到偏差的根本原因。同时,纠正预防措施的充分性和完整性也是难点之一,需避免问题的重复出现。最后,偏差的定期回顾同样不可忽视,需对整体偏差进行分类、分析并采取措施降低质量风险。整个过程中,还需关注受托方是否存在其他异常事件处理流程,并确保所有流程均符合GMP和质量协议的要求,以下是笔者梳理出委托生产中偏差管理的实施过程的现场检查关注要点:
参考文献
[1]http://www.cfdi.org.cn及北京市药品监督管理局官网等



合作咨询
![]() 肖女士
肖女士
![]() 021-33392297
021-33392297
![]() Kelly.Xiao@imsinoexpo.com
Kelly.Xiao@imsinoexpo.com
 2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57
2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57