https://www.cphi.cn 2018-12-11 09:56 来源:药渡
2.Emapalumab(Emapalumab-lzsg)
Emapalumab单抗由NovImmune SA和Sobi共同研发,于2018年11月20日获FDA批准上市,商品名为Gamifant®。该药是一种靶向干扰素-γ(IFN-γ)的全人源单抗,批准用于治疗原发性噬血细胞性淋巴组织细胞增多症(HLH)的成人或婴幼儿患者。早在2012年,Emapalumab被美国FDA和欧盟EMA认证为治疗HLH的孤儿药,还获得FDA授予的突破性疗法认定,此次新药申请也获得了优先审评的资格[6]。Emapalumab获批的意义在于该药是首个获FDA批准用于治疗原发性HLH的药物,可谓是治疗HLH研究中的一个重大突破。
原发性HLH是一种非常罕见,进展迅速,通常致命的高炎症性综合症,属于免疫调节疾病,其中干扰素γ(IFN-γ)的大量过度生成被认为会导致免疫系统过度活跃,最终导致器官衰竭。由于体征和症状的变化,其症状可能包括发烧、严重的低红细胞和白细胞计数、出血性疾病等,导致对该疾病的诊断具有一定难度。据估计,美国每年诊断的原发性HLH病例不足100例,而这种情形可能是诊断不足造成的。如果不进行及时治疗,原发性HLH可迅速致命,中位生存期不到两个月。该疾病前期治疗的直接目标是快速控制高度炎症,为进行造血干细胞移植做准备。目前移植前的常规治疗包括类固醇和化疗,但是这些疗法并未获批用于治疗原发性HLH[7]。Emapalumab作为首个获批治疗原发性HLH的药物,填补了该治疗领域的药物空白。
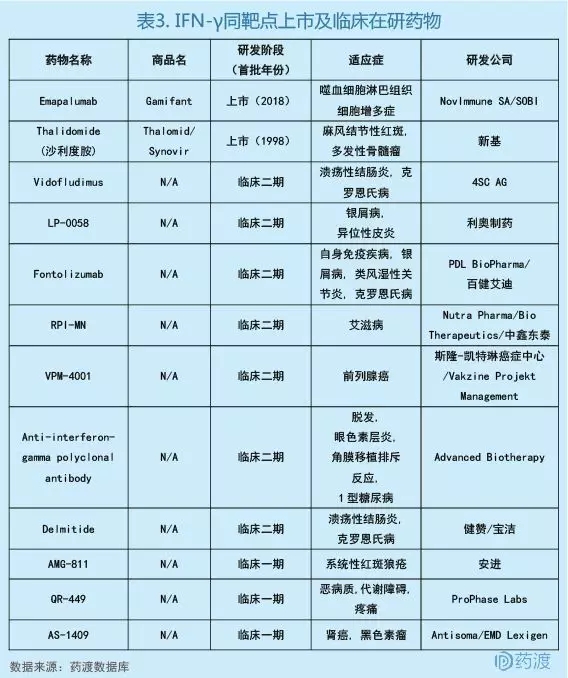
非临床数据表明,IFN-γ通过过度分泌在HLH的发病机制中起关键作用。而Emapalumab是一种结合并中和IFN-γ的单克隆抗体。Emapalumab能降低IFN-γ诱导产生的趋化因子CXCL9的血浆浓度,从而发挥治疗效果[8]。目前针对IFN-γ的上市和在研药物并不是很多,所以针对该靶点的药物开发还是有很大发展空间的。
Emapalumab的获批是基于一项全球,多中心,开放标签,单臂关键性二/三期临床试验(NCT01818492)的结果。该研究对27例原发性HLH患者进行了Emapalumab给药治疗,这些患者属于难治性、复发性或常规治疗仍有疾病进展患者以及对常规治疗不耐受患者,平均年龄为1岁。在试验期间Emapalumab和地塞米松进行联合给药,结果显示,患者的总缓解率为63%(p = 0.013),达到了试验的主要终点。此外,70%的患者接受了造血干细胞移植(HSCT)。研究期间报告的最常见不良反应是感染(56%),高血压(41%),输液相关反应(27%)和发烧(24%)[9]。
Emapalumab代表了治疗原发性HLH、并帮助病情严重的患者进行造血干细胞移植的全新方法。该药物在欧盟也已提交了上市申请,目前正在受理中。期待该药能在更多国家获批,让更多的该类疾病患者早日获益。
3.Glasdegib
Glasdegib由辉瑞公司研发,曾获得FDA认定的孤儿药资格和优先审评资格,并于2018年11月21日获FDA批准上市,商品名为Daurismo®。该药获批与低剂量阿糖胞苷(LDAC)联合用于治疗新确诊的75岁以上,或因其他合并症而无法接受高强度化疗的急性髓细胞白血病(AML)患者。Daurismo®为口服片剂,每片含有25 mg 或者100 mg Glasdegib,推荐剂量为每日一次,每次100 mg[10]。
AML是一种进展十分迅速的骨髓癌,在骨髓中形成并导致血流和骨髓中异常白细胞的数量增加,与其他白血病相比,存活率较低。针对AML患者的标准疗法是高强度化疗,然而,对于许多老年AML患者,以及那些在接受诊断之前有某些健康状况的患者,高强度化疗并不是一种好的治疗选择。由于合并症以及化疗相关的**,几乎一半被诊断为AML的成年人无法得到有效的治疗。美国国家癌症研究所估计,2018年大约有19,520人将被诊断为AML,大约10,670名AML患者将死于该疾病[11][12]。
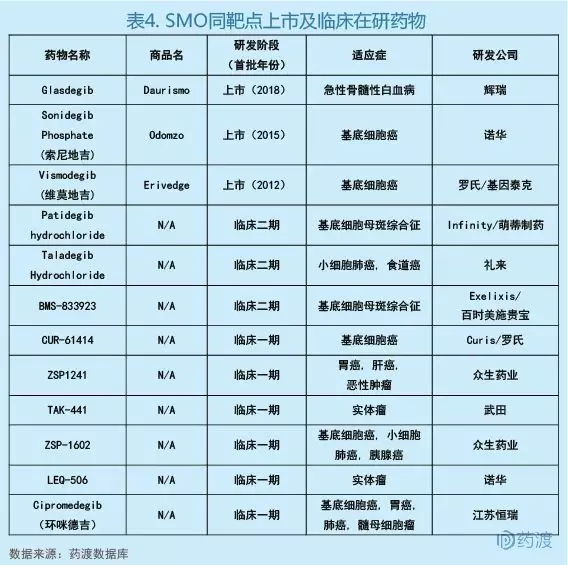
Glasdegib是一种Hedgehog信号通路抑制剂,它能结合并抑制Hedgehog信号转导所需的跨膜蛋白Smoothened[13]。Hedgehog信号通路在胚胎发育过程中发挥着重要作用,而在成人中,该途径的异常激活被认为有助于癌症干细胞的发育和存活。临床前研究表明,抑制这一信号通路会减少癌症干细胞的产生。Glasdegib是目前首个也是唯一一个获得FDA批准的用于治疗AML的Hedgehog通路抑制剂[11]。
Glasdegib的批准是基于其在名为BRIGHT 1003(NCT01546038)的关键性国际随机二期临床试验中的表现。该项试验中,115名新确诊AML患者接受了Glasdegib和LDAC的组合疗法,或者LDAC单药疗法的治疗。试验结果表明,接受Glasdegib和LDAC组合疗法的患者的中位总生存期为8.3个月(95% CI: 4.4, 12.2),显著高于LDAC单药组的4.3个月(95% CI: 1.9, 5.7)。这一结果表明组合疗法将患者死亡风险降低54%(HR: 0.46, 95% CI: 0.30, 0.71, p=0.0002)[14]。
Glasdegib的获批上市为不能接受高强度化疗的AML患者带来了新的选择,为改善他们的生存机会带来了希望。同时,令广大患者们欣慰的是,FDA也加速批准了Venclexta(由艾伯维公司研发,于2016年4月11日获FDA批准上市)与LDAC联用,治疗75岁以上或有合并症的AML患者。这两种联合用药疗法无论市场角逐结果如何,总之最终都能使AML患者受益,为他们提供治疗选择的机会,改善生存率。
如果这篇文章侵犯了您的权利,请联系我们。
投稿合作联系方式: Kelly.Xiao@imsinoexpo.com 021-33392297
地址:上海市徐汇区虹桥路355号城开国际大厦7-8楼 200030