在美国药品监管实践中,PDUFA(处方药用户费用法案,PrescriptionDrugUserFeeAct)日期是指FDA必须对新药申请或生物制品许可申请,做出回应日期的通俗名称。
制药公司通常在提交新药申请时支付用户费,而FDA则在达到PDUFA日期前作出是否批准新药上市的决定,其有助于提高审批效率,加速新药上市,从而更快地使患者获得新的治疗选择。
但并非所有的监管决定,都能按照PDUFA日期准时完成。
01
2023年,
7款新药错过PDUFA日期
2023年,CDER批准了55款新药,但错过了6个PDUFA日期。CBER错过了1个。
这一年里,FDA在遵守PDUFA日期方面的表现,大大违背与他们此前的KPI表现。
7个PDUFA日期的延时,是FDA在过去12年里面的最差表现。
CDER在PDUFA日期到期后批准了6种新药,占CDER2023年批准的55种新分子实体和新型生物制剂的11%。
2023年,CDER在PDUFA日期上的误时案例超过了过去11年的总和(图1)。在2012到2022年的11年间,CDER只有在2015年中错过了一个以上(2个)的PDUFA日期,其中有5年CDER保持了“零”的成绩。
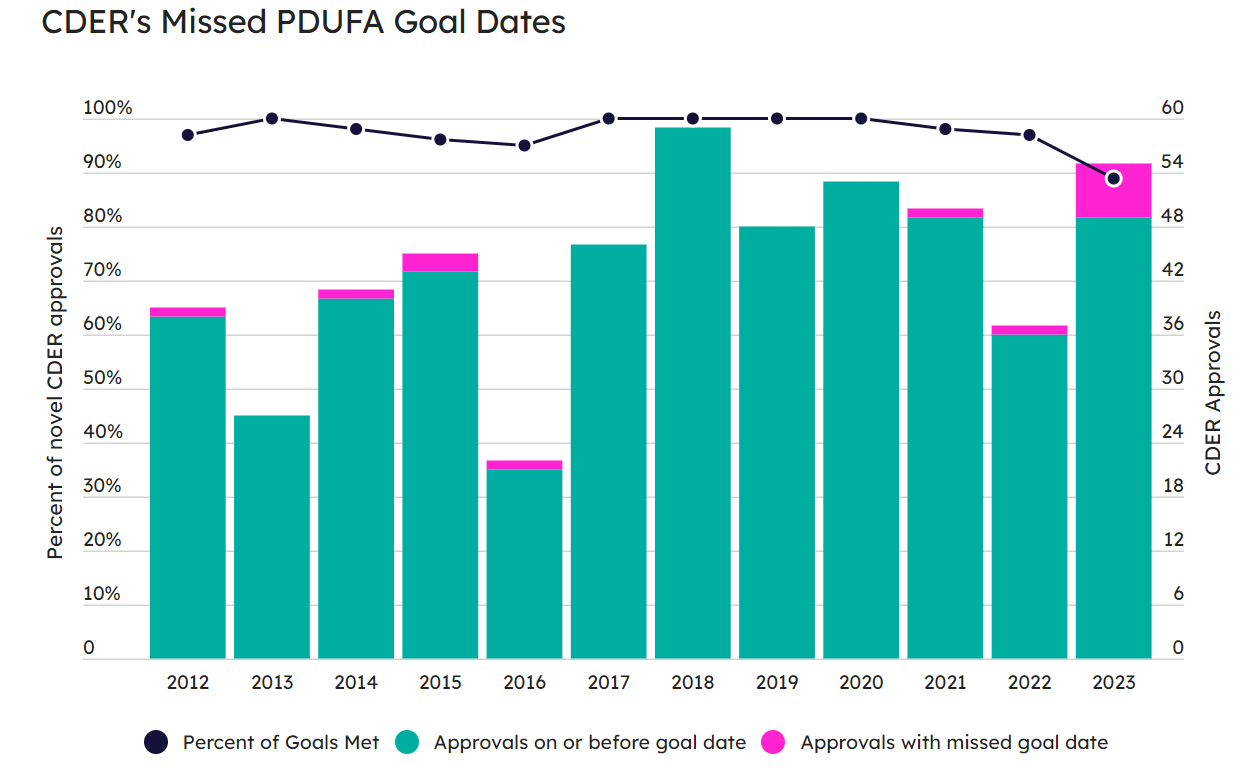
图1CDERZAI2012-2023年间按时和延误审批项目的数量和比例走势图
图片来源:PinkSheet
PDUFA的延时也许对于一般性的药物影响不大,但对那些潜在的重磅炸 弹药物来说就真称得上“一寸光阴一寸金”了。
我们可以做一个粗略的计算:如果一款药物上市后能达到重磅炸 弹的地位,就以最低标准10亿美元来计算,每天的销售额就是274万美元。也就是说,FDA每耽搁一天,重磅炸 弹药物的制药商的损失至少是274万美元,一周1918万美元,一个月8333万美元。
这还是针对羽量级重磅炸 弹,如果是Wegovy这样体量的重磅炸 弹(2023年全年销售量数据尚未出炉,预计在131亿美元左右[[]Malone,E.Top10Best-SellingDrugsOfQ32023:OzempicChallengesHumiraAsKeytrudaExtendsLeadership.Scrip.20.12.2023.]),延误一天等于3589万美元的损失。
以上粗略的计算也解释了为什么有制药公司舍得花费价值在1亿美元左右的优先评审券(PRV,PriorityReviewVoucher)来将他们的资产审批时间缩短4个月。
相对而言,CBER在遵守PDUFA日期这项KPI上表现尚可。只有SareptaTherapeutics的杜氏肌营养不良症基因疗法Elevidys的审批被延误。
CBER去年总共批准了17种新生物制剂,创下历史新高。
02
2023年PDUFA日期延误分析
COVID-19造成的限制,是2023年PDUFA延时最主要的原因。
2023年批准的三种新型药物原本属于2022年的PDUFA日期,但因为Covid-19被推迟到了2023年审批(也被统计入2023年PDUFA延时)。
Covid-19大流行恰逢中国制药公司寻求进入美国肿瘤市场的浪潮,但疫情和中国的防控政策导致了FDA的检查无法按时进行。
EviveBiotech/AcrotechBiopharmaLLC的Ryzneuta(efbemalenograstimalfa-vuxw)是一种长效粒细胞集落刺激因子融合蛋白,用于治疗化疗引起的中性粒细胞减少症,其PDUFA时间是2022年3月30日,但直到2023年11月16日才获得批准,因为Evive的北京原料药生产场地到2023年6月才能接受检查。
同样,对无锡药明生物原料药和药品生产基地的检查也导致了AmicusTherapeutics,Inc.的Pombiliti(cipaglucosidasealfa-atga)的审批延迟。Pombiliti是一种针对罕见疾病庞贝病的酶替代疗法。
君实生物和CoherusBioSciences,Inc.d的Loqtorzi(toripalimab-tpzi)是一款抗PD-1单克隆抗体,PDUFA日期为2022年12月23日,同样因为疫情控制而无法按时进行,最终于2023年10月27日获批,推迟了10个月的时间。
另一款PD-1抑制剂是tislelizumab,目前仍在等待FDA的监管决定,距治疗食管鳞状细胞癌的初设PDUFA日期(2022年7月12日)已过去了17个多月。
康方生物和中国生物制药的PD-1抑制剂penpulimab错过了2022年1月的三线NPC的PDUFA审批日期。
FDA于2023年10月17日批准了UCB的Bimzelx(bimekizumab-bkzx)用于治疗斑块状银屑病,但此时已经距离其2020年7月15日BLA申请提交过去了三年零三个月,其中两次未能遵循PDUFA日期规定审批。
CBER的PDUFA延期案例的原因较为清晰。
CBER2023年PDUFA延期孤例的“事主”是Sarepta的杜氏肌营养不良症基因疗法Elevidys。这款药物的上市本身就充满了争议。CDER在2016年加速批准Sarepta的外显子跳跃Exondys51(eteplirsen)时,就已经制造出了FDA最 具争议的事件之一。
2023年,Sarepta再次为FDA奉上一份烫手山芋,只不过这次换成了CBER来决定Elevidys这款基因疗法的命运。
CBER最初的反应是拒绝审查这份申请,但被CBER主任PeterMarks压下。由于对Elevidys替代终点的有效性和临床数据的分歧,CBER没有能够在Elevidys的2023年5月29日PDUFA日期做出监管决定。
最终FDA进行了专家咨询会议进行投票表决,Elevidys在6月22日获得了批准。
表1FDA2023年PDUFA日期延期一览表
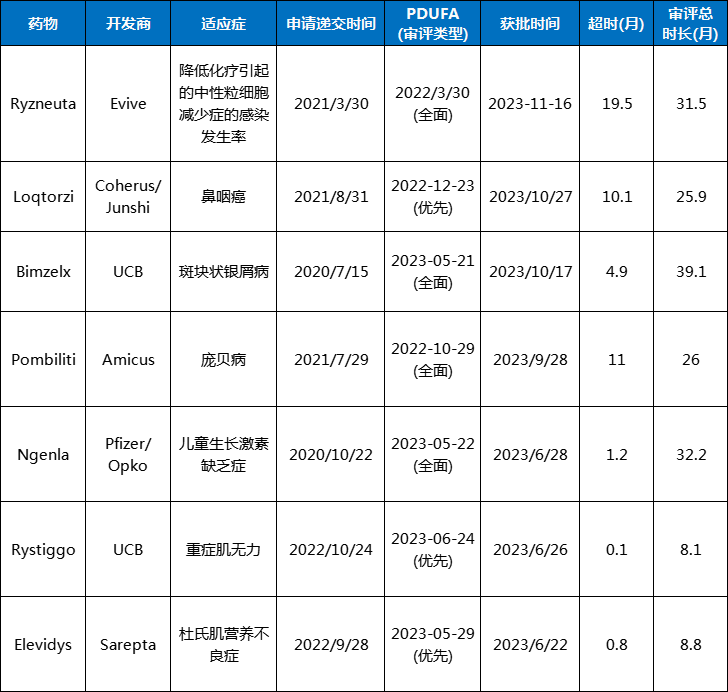
数据来源:FDA官网
注:本文中延期的案例,针对的是PDUFA时间延期,但在2023年获批的情况。并非是2023年PDUFA没有按期审评的情况。
1.Malone,E.Top10Best-SellingDrugsOfQ32023:OzempicChallengesHumiraAsKeytrudaExtendsLeadership.Scrip.20.12.2023.
2.Yan,D.Closed-LoopInspections?StrictCOVIDZeroPolicyDelaysUSFDA’sChinaFieldTrips.PinkSheet.26.05.2023.
3.Sutter,S.Sarepta'sEteplirsenApprovedAfterContentiousInternalFDADebate.PinkSheet.16.09.2016.



合作咨询
![]() 肖女士
肖女士
![]() 021-33392297
021-33392297
![]() Kelly.Xiao@imsinoexpo.com
Kelly.Xiao@imsinoexpo.com
 2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57
2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57