FDA 在2023年批准了55种新药和34种细胞和基因疗法。2024年至今FDA批准和拒批了多款药物,下文一一揭晓。
2024年FDA已批准药物
Opsynvi(马西替坦和他达拉非组合疗法)
适应症:肺动脉高压

图1.Macitentan(左)、Tadalafil (右)结构式(图片来源:药渡数据)
2024年3月22日,强生宣布FDA批准其Opsynvi单片剂组合疗法,用于长期治疗世界卫生组织(WHO)功能分级(FC)为II-III级的肺动脉高压(PAH)成人患者[1,2]。根据新闻稿,Opsynvi是首 个获FDA批准的PAH单片剂组合疗法。
此次获批主要基于关键的A DUE临床3期研究结果,其中Opsynvi证明与马西替坦或他达拉非单药治疗相比,患者在接受治疗16周后在肺血管阻力(PVR)上有了更大的降低。
Duvyzat
适应症:杜氏肌营养不良症
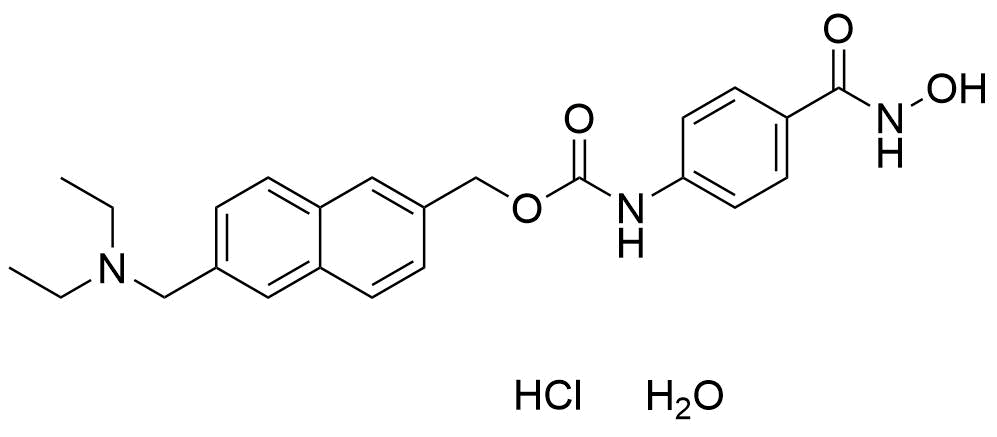
图2.Givinostat hydrochloride monohydrate结构式(图片来源:药渡数据)
2024年3月21日,FDA批准Italfarmaco/ITF的口服药物Duvyzat(givinostat)上市,用于治疗六岁及以上患者的杜氏肌营养不良症(DMD)。
Duvyzat是一种组蛋白脱乙酰酶(HDAC) 抑制剂,通过靶向致病过程来减少炎症和肌肉损失;它是第一个被批准用于治疗所有DMD基因变异患者的非甾体药物。
Duvyzat在一项为期18个月的随机、双盲、安慰剂对照的3期研究中评估了 Duvyzat治疗DMD的疗效。主要终点是从基线到第18个月的变化,使用四级爬升来测量肌肉功能。
在整个研究过程中,所有参与者继续接受标准的类固醇治疗方案,经过18个月的治疗,与安慰剂相比,接受Duvyzat治疗的患者爬四个楼梯所需的时间下降幅度较小,具有统计学意义。接受Duvyzat的患者从基线到第18个月爬四个楼梯的平均变化为1.25秒,而接受安慰剂的患者为3.03秒。
Idorsia's Tryvio
适应症:高血压

图3.Aprocitentan结构式(图片来源:药渡数据)
2024年3月20日,FDA批准Tryvio(aprocitentan,阿普昔腾坦)用于与其他抗高血压药物联合治疗高血压,以降低使用其他药物无法充分控制的成年患者的血压,近40年来第一个通过新的治疗途径起作用的口服抗高血压疗法。
Tryvio是一种内皮素受体拮抗剂,可抑制内皮素(ET)-1与ETA和 ETB受体的结合。
此次批准得到了3期PRECISION试验数据的支持,PRECISION是一项多部分、3期多中心研究,评估了Tryvio在收缩压(SBP)≥140mmHg成人患者中的疗效,这些成人至少服用了三种抗高血压药物。
研究结果显示:在治疗四周后,与安慰剂相比,Tryvio的12.5mg和25mg剂量水平均显著降低了坐位收缩压。
Iclusig
适应症:费城染色体阳性急性淋巴细胞白血病

图4.Ponatinib Hydrochloride结构式(图片来源:药渡数据)
2024年3月19日,FDA加速批准武田的Iclusig用于新诊断的费城染色体阳性急性淋巴细胞白血病(Ph+ ALL)成人患者的化疗,是美国首 个联合化疗一线治疗Ph+ ALL患者的靶向治疗药物。
此次补充批准是基于3期PhALLCON试验的数据,在该试验中,Iclusig治疗可实现更高的MRD阴性完全缓解率,并且在新诊断的Ph+ ALL成人患者中具有与诺华格列卫相当的安全性。所有患者也接受了低强度化疗。
Lenmeldy
适应症:异染性脑白质营养不良
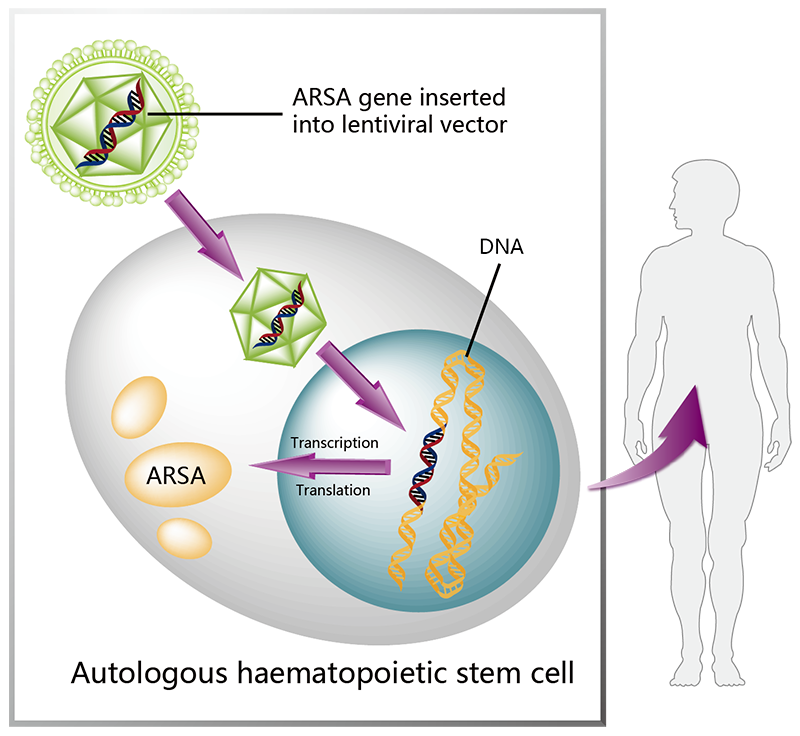
图5.Lenmeldy的作用机制(图片来源:药渡数据)
2024年3月18日,FDA批准了Lenmeldy(atidarsagene autotemcel),用于治疗症状前晚期婴儿、症状前早期青少年异染性脑白质营养不良(MLD)的患者,是FDA批准的第一个用于该适应症的基因疗法。
此次批准是基于37名儿童的数据评估的Lenmeldy的安全性和有效性,这些儿童在两项单臂、开放标签临床试验和一项扩大准入计划中接受了Lenmeldy治疗。
研究结果显示:在MLD儿童患者中,与未经治疗的儿童相比,Lenmeldy治疗显著降低了严重运动障碍或死亡的风险。
所有接受Lenmeldy治疗的症状前晚期婴儿的MLD儿童在6岁时存活,而自然病程组中只有58%存活。在5岁时,71%的接受治疗的儿童能够在没有帮助的情况下行走。85%接受治疗的儿童能够得到正常的语言和智商分数,这在未经治疗的儿童中没有报道。此外,患有症状前早期青少年和早期症状早期青少年MLD的儿童表现出运动和/或认知疾病的减慢。
Rezdiffra
适应症:非酒精性脂肪性肝炎

图6.Resmetirom结构式(图片来源:药渡数据)
2024年3月14日,Madrigal Pharmaceuticals宣布FDA批准Rezdiffra? (resmetirom)上市,用于治疗患有中重度肝纤维化(F2至F3期)的非肝硬化非酒精性脂肪性肝炎(NASH)患者,Rezdiffra成为FDA批准的首 款NASH疗法,具有里程碑意义。
此次Rezdiffra获FDA加速批准是3期MAESTRO-NASH试验的结果:80mg resmetirom组25.9%的患者和100mg resmetirom组29.9%的患者实现了NASH消退且纤维化无恶化,而安慰剂组为9.7%。
在80mg resmetirom组中,24.2%的患者实现了至少一个阶段的纤维化改善,NAFLD活性评分没有恶化,100mg resmetirom组为25.9%,而安慰剂组为14.2%[3]。
Breyanzi
适应症:慢性淋巴细胞白血病和小淋巴细胞白血病
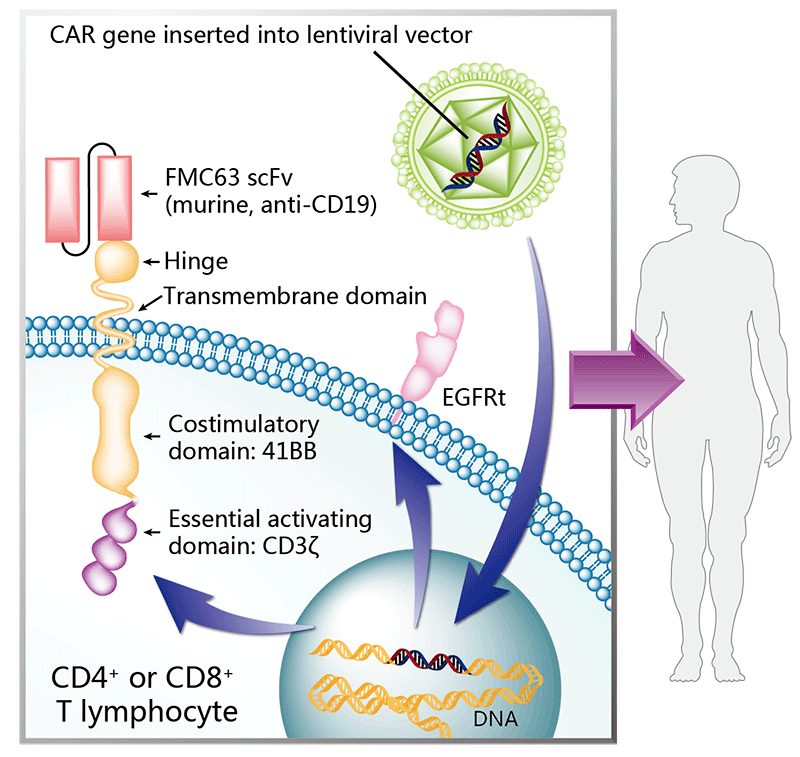
图7.Breyanzi的作用机制(图片来源:药渡数据)
2024年3月14日,BMS宣布FDA已加速批准CD19定向嵌合抗原受体(CAR)T细胞疗法Breyanzi®(lisocabtagene maraleucel;liso-cel)用于治疗既往接受过至少两线治疗的复发或难治性慢性淋巴细胞白血病(CLL)或小淋巴细胞淋巴瘤(SLL)成人患者。
此次获批是基于关键的1/2期TRANSCENT CLL 004试验的结果:在该试验中,CAR-T疗法的治疗导致20%的完全缓解率和45%的总缓解率,中位缓解持续时间为35.3个月。在接受Breyanzi治疗且达到CR的患者中观察到高微小残留病(MRD)阴性状态,血液中的MRD阴性率为100%,骨髓中的MRD阴性率为92.3%。
Tevimbra
适应症:食管鳞状细胞癌
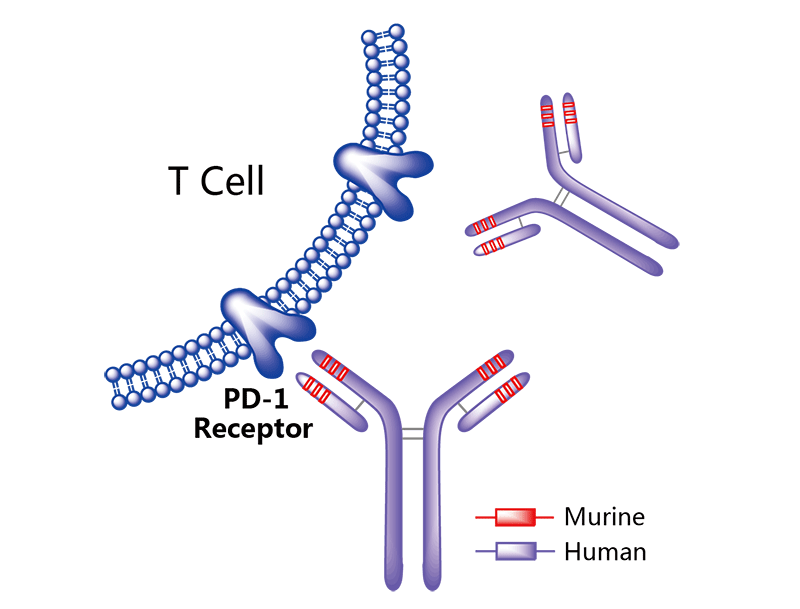
图8.Tevimbra的作用机制(图片来源:药渡数据)
2024年3月14日,FDA批准百济神州的Tevimbra(tislelizumab,替雷利珠单抗)用于治疗既往化疗后的晚期或转移性食管鳞状细胞癌。
此次批准基于RATIONALE 302试验,该试验在意向治疗(ITT)人群中达到了主要终点,与化疗相比,Tevimbra具有统计学意义和临床意义的生存获益。在ITT人群中,Tevimbra组的中位总生存期(OS)为8.6个月(95%CI:7.5,10.4),而化疗组为6.3个月(95%CI:5.3,7.0)(p=0.0001;风险比[HR]=0.70 [95%CI:0.57,0.85])。
Tevimbra的安全性优于化疗。TEVIMBRA 最常见的(≥20%)不良反应,包括实验室异常、葡萄糖升高、血红蛋白降低、淋巴细胞减少、钠降低、白蛋白降低、碱性磷酸酶升高、贫血、疲劳、AST 增加、肌肉骨骼疼痛、体重减轻、ALT升高和咳嗽。
Livmarli
适应症:PFIC中的胆汁淤积性瘙痒

图9.Maralixibat结构式(图片来源:药渡数据)
2024年3月13日,Mirum Pharmaceuticals宣布FDA已批准Livmarli(maralixibat)口服溶液,用于治疗5岁及以上进行性家族性肝内胆汁淤积症(PFIC)患者的胆汁淤积性瘙痒。
Mirum还提交了一份额外的补充新药申请(sNDA),以引入在MARCH研究期间使用的更高浓度的Livmarli制剂,以便在今年晚些时候为年轻的PFIC患者扩展标签。
此次批准基于3期MARCH研究的数据,该研究是在PFIC中进行的最大随机试验,包括93名患者,涉及一系列遗传PFIC类型,包括PFIC1、PFIC2、PFIC3、PFIC4、PFIC6和未确定的突变状态。
研究结果显示:接受Livmarl治疗的患者在瘙痒(p<0.0001)、血清胆汁酸(p<0.0001)、胆红素(p=0.0471)和以体重Z评分(Z-score)评估的生长(p=0.0391)方面有统计学意义上的改善。
APP13007
适应症:缓解眼科手术后的炎症和疼痛

图10.Clobetasol Propionate结构式(图片来源:药渡数据)
2024年3月4日,Eyenovia和开发合作伙伴台塑制药(Formosa Pharmaceuticals)联合宣布FDA已批准APP13007(丙酸氯倍他索眼用纳米混悬液,0.05%)滴眼剂,用于缓解眼科手术后的炎症和疼痛。该滴眼液预计将于今年夏季上市。
根据两家公司的公告,该产品是第一个获得FDA批准的眼科氯倍他索丙酸酯药物,也是15年来第一个进入眼科领域的类固醇。该批准得到了两项关键III期试验的支持,这些试验表明丙酸氯倍他索滴眼液可以在治疗后14天内快速显著地清除眼部炎症并缓解眼部疼痛。该产品耐受性良好,安全性与安慰剂相似。
Letybo
适应症:成人中度至重度眉间纹
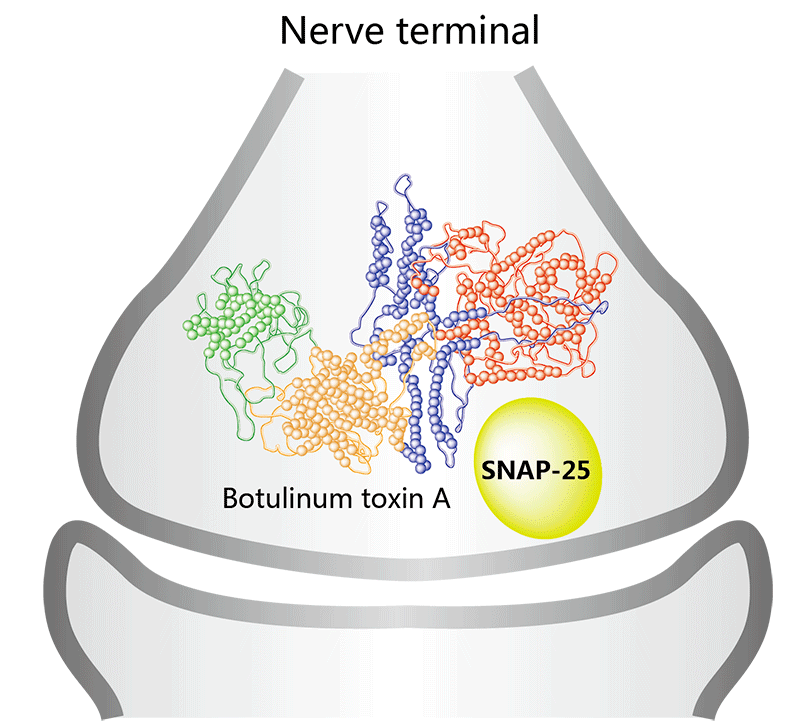
图11.Letybo的作用机制(图片来源:药渡数据)
2024年3月4日,Hugel America宣布FDA批准了其A型肉毒 毒素Letybo(letibotulinumtoxinA-wlbg),用于治疗成人中度至重度眉间纹。
Letybo的批准得到了三项3期试验的数据的支持,该试验包括1,200多名参与者,并显示该药物取得了显着的治疗成功,定义为没有或轻度眉间线,并且根据其结果,眉间线量表与基线相比至少改善了两分。
Exblifep(头孢吡肟和恩美唑巴坦组合疗法)
适应症:尿路感染

图12.Enmetazobactam(左)、Cefepime Hydrochloride(右)结构式(图片来源:药渡数据)
2024年2月27日,Allecra Therapeutics宣布FDA批准其用于尿路感染(UTI)药物Exblifep上市。
此次批准是基于数据显示该药物对革兰氏阴性菌抗菌素耐药性的有效性,特别是由广谱β内酰胺酶和AmpC介导的耐药性。
与哌拉西林/他唑巴坦相比,Exblifep在复杂性尿路感染患者临床治愈和微生物根除的主要结局方面符合非劣效性和优越性标准。
lifileucel
适应症:晚期黑色素瘤
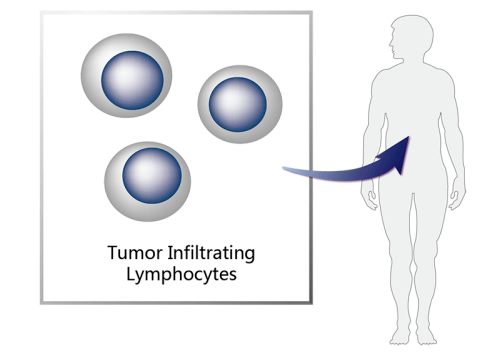
图13.lifileucel的作用机制(图片来源:药渡数据)
2024年2月17日,Iovance Biotherapeutics宣布FDA已加速批准该公司的肿瘤浸润淋巴细胞(TIL)疗法Amtagvi(lifileucel),用于治疗晚期黑色素瘤。
根据新闻稿,lifileucel是首 款获批的TIL疗法,也是首 款获批治疗实体瘤的T细胞疗法,是细胞疗法的又一里程碑。
此次批准主要是基于C-144-01试验的结果,该试验的主要疗效结局指标是客观缓解率(ORR)和缓解持续时间(DoR)。对lifileucel的初始反应的中位时间为1.5个月。ORR基于73名受试者,他们在7.5x109至72x109活细胞的推荐剂量范围内接受lifileucel。ORR为31.5%(95%CI:21.1,43.4),未达到中位DoR(NR)(95%CI:4.1个月,NR)。
Aurlumyn
适应症:成人严重冻伤
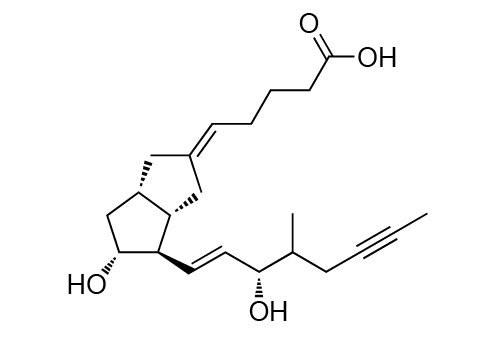
图14.Iloprost (Eicos Sciences)结构式(图片来源:药渡数据)
2024年2月16日,FDA正式批准Eicos Sciences的Iloprost注射液,商品名为Aurlumyn,用于治疗成人严重冻伤,以降低患者手指或脚趾截肢的风险,成为全球首 个用于治疗严重冻伤的获批药物。
Iloprost是一种血管扩张剂,其作用方式是松弛血管并防止凝块形成。此次批准Iloprost治疗严重冻伤是基于一项开放标签对照试验中获得的积极结果:第7天时,仅接受iloprost治疗的患者(第1组)中,骨扫描结果显示需要截肢的比例为0%(n=0/16),而第2组中这一比例为19%(n=3/16),第3组中为60%(n=9/15)。
接受iloprost治疗的两组患者中,骨扫描异常的发生率显著较低。对大多数患者进行了关于是否需要至少截肢一根手指或脚趾的随访,数据显示患者的截肢需求与骨扫描结果一致。
Onivyde
适应症:转移性胰腺腺癌

图15.Nanoliposomal Irinotecan hydrochloride结构式(图片来源:药渡数据)
2024年2月13日,FDA批准益普生公司的Onivyde(伊立替康脂质体注射液)与三种化疗药物联合使用,用于治疗新诊断的转移性胰腺腺癌患者。
此次批准基于3期NAPOLI 3试验,其中Nalirifox方案(将Onivyde与氟尿嘧啶、奥沙利铂和亚叶酸相结合)与标准治疗相比,将总生存期(OS)提高了 17%,具有统计学意义。Nalirifox还将无进展生存期提高了31%。
NAPOLI 3是第一个在mPDAC中显示出更好的OS的阳性3期试验,与目前的标准治疗方案相比,该方案由白蛋白结合型紫杉醇和吉西他滨组成。
Casgevy
适应症:输血依赖性β-地中海贫血(TDT)
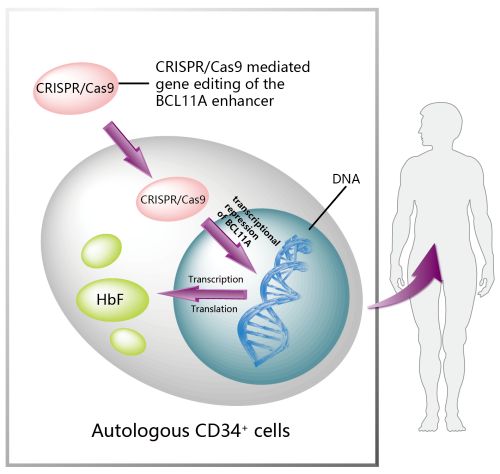
图16.Casgevy的作用机制(图片来源:药渡数据)
2024年1月16日,FDA批准了Vertex Pharmaceuticals和CRISPR Therapeutics的Casgevy(exagamglogene autotemcel)作为输血依赖性β-地中海贫血(TDT)的一次性治疗药物,比Casgevy在3月30日的处方药使用者付费法案(PDUFA)日期提前了两个多月。
2024年FDA已拒批药物
GA Depot 40
适应症:复发性多发性硬化症
2024年3月11日,Viatris和Mapi Pharma宣布FDA已经拒绝批准其用于治疗复发性多发性硬化症的醋酸格拉替雷研究性制剂GA Depot 40。
根据公告,开发合作伙伴目前正在审查完整回复函,以更好地确定GA Depot的“适当的后续步骤”,并继续相信其作为“多发性硬化症患者的重要新治疗进展”的潜力。
Viatris和Mapi用来自1000多名患者的III期数据来支持他们的NDA,这些患者总共接受了13剂40毫克GA长效或安慰剂。两家公司报告称,与安慰剂相比,GA Depot将年化MS复发率降低了30.1%。
Roluperidone
适应症:精神分裂症的阴性症状
2024年2月27日,Minerva Neurosciences宣布FDA拒绝了其用于治疗精神分裂症的阴性症状药物Roluperidone。虽然一项研究确实显示出统计学意义,但FDA在一封完整的回复信中表示,它“不足以提供有效的实质性证据”。
FDA还指出,新药上市申请缺乏关于同时服用抗精神病药物的数据,没有包括确定阴性症状的变化具有临床意义的数据,并且提交的安全数据库中“暴露于Roluperidone的受试者数量不足”,建议剂量为64mg至少12个月。
cefepime-taniborbactam
适应症:尿路感染
2024年2月23日,Venatorx Pharmaceuticals和Melinta Therapeutics宣布FDA因CMC问题拒绝批准其抗生素头孢吡肟-他尼硼巴坦的上市,头孢吡肟-他尼硼巴坦是一种β-内酰胺/β-内酰胺酶抑制剂联合抗生素,旨在治疗患有复杂性尿路感染的成人。
在FDA完整回复函中,FDA要求提供额外的CMC以及有关药物,测试方法和制造过程的相关数据。监管机构没有引用与头孢吡肟-他尼硼巴坦新药申请中提供的临床安全性或有效性相关的任何问题。
zolbetuximab
适应症:局部晚期不可切除或转移性HER2阴性胃癌或胃食管交界处 (GEJ)腺癌
2024年1月8日,安斯泰来宣布FDA已拒绝批准的靶向claudin 18.2(CLDN18.2)的疗法zolbetuximab上市,claudin 18.2是一种在胃上皮癌细胞表面表达的跨膜蛋白。
根据安斯泰来1月4日发布的完整回复函,第三方生产工厂的“未解决缺陷”是zolbetuximab申请批准被拒的原因。



合作咨询
![]() 肖女士
肖女士
![]() 021-33392297
021-33392297
![]() Kelly.Xiao@imsinoexpo.com
Kelly.Xiao@imsinoexpo.com
 2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57
2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57