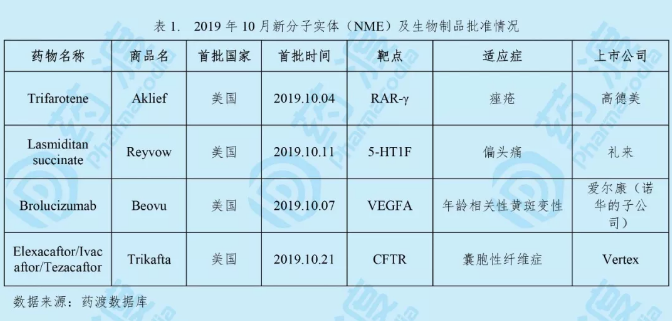
2019年10月,全球首次批准新药主要集中在美国。美国食品药品监督管理局FDA批准2个新分子实体药物(NME)、1个生物制品和1个复方,分别是治疗痤疮的Trifarotene,治疗偏头痛的Lasmiditan succinate,治疗年龄相关性黄斑变性的Brolucizumab和治疗囊胞性纤维症的Elexacaftor/Ivacaftor/Tezacaftor。
1
Trifarotene
Trifarotene由高德美(Galderma)研发,之后Mayne Pharma获得了该药的全球授权。于2019年10月4日获得FDA批准上市,用于治疗痤疮,商品名为Aklief®。Trifarotene是二十多年来首款获得美国FDA批准用于治疗痤疮的新型类维生素A分子。也是第一个经过专门研究并证明可治疗面部(前额、脸颊、鼻子和下巴)和截头(胸部、肩膀和背部)痤疮的局部治疗药物,为痤疮患者提供一种新的治疗选择[1]。
痤疮又称粉刺,是一种常见慢性炎症性皮肤病,由皮脂和死皮细胞的结合物堵塞毛孔导致。脸上痤疮是最常见的表现疾病。超过一半的面部痤疮患者(52%)也患有截头痤疮。据统计,80%的人在一生某些时候会出现痤疮,但常见于青春期,严重痤疮可能会对患者的正常生活和心理健康造成影响[2]。
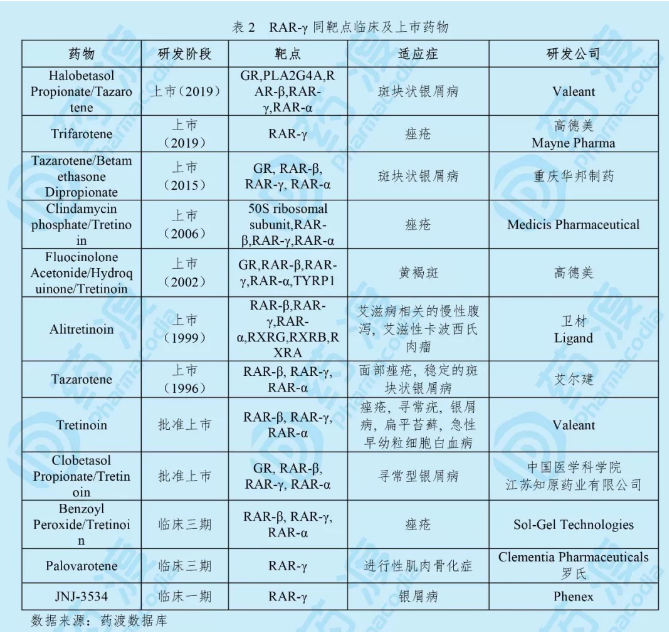
Aklief®是一种维甲酸受体γ(RARγ)激动剂。为局部用乳膏,含量为0.005%。推荐用法为每天晚上将Aklief®乳膏涂于面部和/或躯干患处[3]。
Aklief ®的获批基于两项每日一次为期12周随机,多中心,平行组,双盲,媒介对照的关键性3期临床试验结果。参于试验患者2,420名,试验结果显示,与媒介物相比,Aklief®软膏可在两周内显著减少炎症性病变。Aklief®软膏当在面部、背部、肩膀和胸部使用时,耐受性良好。最常见的不良反应(发生率>1%)包括施药部位刺激,施药部位瘙痒和晒伤[3][4]。
2
Lasmiditan succinate
Lasmiditan succinate由礼来公司研发,于2019年10月11日获得美国食品药品监督管理局(FDA)批准上市,商品名为Reyvow®。这是FDA批准的首款也是唯一一款5-羟色胺(5-HT)1F受体激动剂,属于“地坦”类药物[5]。
偏头痛是一种最常见原发性头痛,发病时往往伴随着头痛的其他症状,比如恶心、呕吐等,光、声刺激或日常活动增加均可加重病情。偏头痛的发病率非常高,据FDA的调研数据,在美国约有3,000万成年人正受到偏头痛的困扰,超过2%的美国人每月超过半个月的时间持续受到偏头痛的困扰[6]。
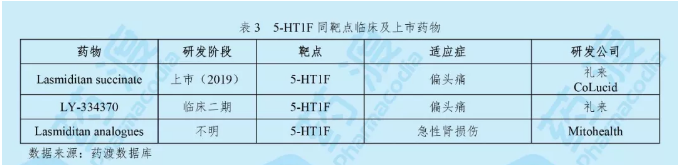
Reyvow®是一种5-羟色胺(5-HT)1F受体激动剂。它能够与5-HT1F受体以高亲和力相结合。该药物与曲坦类药物的作用机制不同,它靶向并激活5-HT1F受体,通过与降钙素基因相关肽(CGRP)结合阻断偏头痛发生机制。礼来表示,人体血管上未发现CGRP受体,因此Reyvow®不会使血管收缩,适用于高血压及心脏病患者。Reyvow®是一种口服片剂,规格为50 mg和100 mg。推荐用药为按需口服50 mg、100 mg或者200 mg。每次间隔用药至少24小时[5]。
Reyvow®的疗效在两项随机双盲,含安慰剂对照的3期临床试验(SAMURAI和SPARTAN)中得到验证。3177名有偏头痛历史患者参加了这两项临床试验。研究目的主要评估Reyvow®对成人偏头痛急性治疗的安全性和有效性。试验结果表明,Reyvow®组与安慰剂组相比,在服药2个小时后患者头痛完全消失的比例显著提高,Reyvow®同时显著消除其它困扰患者的偏头痛症状(恶心和声光敏感)。此外,在对曲坦类药物反应不足患者亚群中,Reyvow®也能产生良好效果。在临床试验中最常见副作用是头晕、疲劳、灼烧或刺痛等,患者服用8小时内不能驾车和从事高空作业[7]。
3
Brolucizumab
Brolucizumab由爱尔康(诺华的子公司)研发销售,于2019年10月7日获得美国食品药品监督管理局(FDA)批准上市,商品名为Beovu®。该药的上市申请已经向欧盟EMA递交。2019年3月,诺华在中国提交IND申请获得CDE受理,申报适应症为:糖尿病性黄斑水肿(DME)引起的视力损害、治疗湿性(新生血管性)年龄相关性黄斑变性(AMD)和继发于视网膜静脉阻塞(RVO)(视网膜分支静脉阻塞(BRVO)或视网膜中央静脉阻塞(CRVO))的黄斑水肿引起的视力损害。2019年5月CDE公示临床试验默示许可[8]。
湿性年龄相关性黄斑变性(wet-AMD,又名新生血管性AMD,nAMD),是由黄斑下血管过度增生引起的一种慢性退行性眼病。VEGF是一种促进黄斑下方异常血管生长的蛋白质,黄斑是负责清晰中央视线的视网膜区域。从这些异常血管中渗出的液体会破坏正常的视网膜结构,最终损害黄斑。湿性AMD扭曲了中心视力,导致失明和失去独立性,它影响着全球2,000多万人,频繁的注射是AMD患者放弃治疗的常见原因[9]。
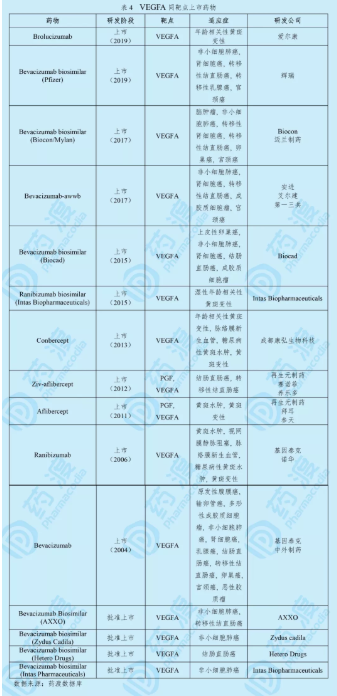
Beovu®是一种靶向血管内皮生长因子A(VEGF-A)的重组人源化单链抗体,CDR区为兔源(Oryctolagus cuniculus),是目前达到开发阶段临床上最先进的人源化单链抗体片段(scFv)。单链抗体片段仅有26kDa大小, 因其体积小、组织渗透性增强及其全身循环里快速清除而在药物开发中备受关注。Beovu®是一种玻璃体内给药的溶液,单瓶含有0.5 mL,含有Beovu®抗体6 mg。推荐剂量为每月注射6 mg(0.05 mL溶液,120 mg/mL),前三次给药每次间隔约25~31天。之后每8~12周给药一次6 mg[8]。
Beovu®对VEGF-A所有亚型均有很强的抑制作用,并具有很高的亲和力。在临床前研究中,Beovu®通过阻断配体-受体相互作用来抑制VEGF受体的激活。增加的VEGF途径信号与病理性眼部血管生成和视网膜水肿有关。在脉络膜视网膜血管疾病患者中,抑制VEGF途径可抑制新生血管病变的生长以及液体渗入视网膜的可能性,从而缓解视网膜水肿,改善视力[9]。
Beovu®的批准基于两项前瞻性、随机、双盲、多中心3期HAWK(NCT02307682)和HARRIER(NCT02434328)临床实验结果。在wet-AMD患者中开展评估了Beovu®相对于Eylea®的疗效和安全性。结果表明,两项研究均达到了主要终点,在治疗第一年(第48周),Beovu®(6 mg)在改善视力方面疗效非劣效于Eylea®,具体数据为:HAWK研究和HARRIER研究中,Beovu®(6 mg)治疗组最佳矫正视力(BCVA)相对基线的平均变化分别为6.6个字母(Eylea®治疗组为6.8个字母)和6.9个字母(Eylea®治疗组为7.6个字母)。两项研究中,大约30%患者在治疗一年时BCVA提高至少15个字母。此外,Beovu®(6 mg)在疾病进展关键指标的3个次要终点方面也表现出优势:疾病活动度、中央视野视网膜厚度、视网膜液(视网膜内液和/或视网膜下液)。具体数据为:(1)在治疗第48周,与Eylea®治疗组相比,Beovu®(6 mg)治疗组疾病活动患者比例更低(HAWK研究:23.5% vs 33.5%,p=0.0022;HARRIER研究:21.9% vs 31.4%,p=0.0022);(2)在治疗第48周,与Eylea®治疗组相比,Beovu®(6 mg)治疗组视网膜液关键标志物显著减少:存在视网膜内液(IRF)和/或视网膜下液(SRF)的患者比例方面,HAWK研究中减少31%(p<0.0001)、HARRIER研究中减少26%(p<0.0001)。值得一提的是,在HAWK和HARRIER研究中,符合条件患者可以在负荷期之后立即维持3个月给药间隔。在第一年,有超过一半患者维持3个月给药间隔,其中HAWK研究为56%,HARRIER研究为51%,其余患者给药间隔为2个月[10]。
Beovu®是首个在治疗第一年就能提供较少给药频率同时维持治疗有效性的药物,这将使wet-AMD患者有更多时间关注生活中其它重要事情。Beovu®的上市,将为wet-AMD患者群体带来一款差异化的产品[10]。
4
Elexacaftor/Ivacaftor/Tezacaftor
Elexacaftor/Ivacaftor/Tezacaftor由Vertex公司研发,于2019年10月21日获得美国食品药品监督管理局(FDA)批准上市,商品名为Trikafta®。Vertex公司是囊性纤维症(CF)治疗领域的全球领导者,已上市CF药物包括Ivacaftor、Lumacaftor/Ivacaftor和Tezacaftor/Ivacaftor,这三种药物可医治全球约40,000例患者,约占所有CF患者的50%。而此次获批的三联创新疗法Trikafta®可将医治规模扩大到全球CF患者的90%[11]。
囊性纤维症(CF)是由囊性纤维化跨膜电导调节因子(CFTR)基因突变导致CFTR蛋白功能缺失或缺陷的罕见遗传疾病,该病困扰全球约7万人。通常CFTR蛋白调节细胞膜的离子运输,当细胞膜离子运输被中断时,某些器官粘液涂层的粘度将变稠。CF的一个主要特征是呼吸道积聚厚厚的粘液,导致呼吸 困难、消化问题以及其它并发症[12]。
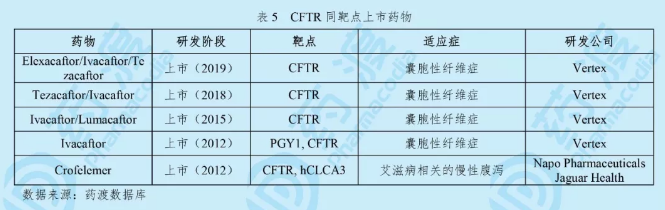
Trikafta®由三种有效成分构成。其中Elexacaftor是新一代CFTR蛋白矫正剂,它用于恢复携带F508del突变的CFTR蛋白功能,从而改善CF患者的呼吸功能;Tezacaftor可通过增加CFTR蛋白转运到细胞表面水平来增强CFTR蛋白功能;而Ivacaftor是一种能增加氯化物转运的囊性纤维化跨膜传导调节因子(CFTR)蛋白增效剂,可以通过延长细胞表面CFTR蛋白的开放时间来提高缺陷型CFTR蛋白功能[13]。Trikafta®是一种联合包装的固定剂量复方片剂,由Elexacaftor 100 mg、Tezacaftor 50 mg和Ivacaftor 75 mg组成的复方片剂以及Ivacaftor 150 mg单方片剂。12岁及以上的患者每日推荐剂量为,早晨:两粒复方片剂;晚上:一粒单方片剂[14]。
Trikafta®批准基于两项针对12岁及以上CF患者的全球3期临床试验的积极结果。在第一项随机双盲,含安慰剂对照的3期临床试验中,Trikafta®用于治疗携带一个F508del基因突变和一个最小功能突变的患者。试验结果表明,在接受治疗4周以后,治疗组患者与接受安慰剂治疗的对照组相比,肺功能显著提高,一秒用力呼气容积占预期值的百分比(ppFEV1)的平均绝对值与基线相比,改善13.8%(p<0.001)。在第二项3期临床试验中,携带两个F508del CFTR基因突变CF患者接受Trikafta®治疗,或者安慰剂与Tezacaftor和Ivacaftor构成的三联疗法治疗。试验结果表明,将Elexacaftor加入到Tezacaftor和Ivacaftor构成的治疗方案中,能够将ppFEV1的平均绝对值改善10%(p<0.001)[14]。
参考资料
1. 药渡数据:https://data.pharmacodia.com/web/basic/basic_detail_PN9817.html (accessed October 2019).
2. Galderma. https://www.galderma.com/news/galderma-receives-fda-approval-akliefr-trifarotene-cream-0005-first-new-retinoid-molecule (accessed October 2019).
3. FDA Database. https://www.accessdata.fda.gov/drugsatfda_docs/label/2019/211527s000lbl.pdf (accessed October 2019).
4. JAAD. https://www.jaad.org/article/S0190-9622(19)30335-4/fulltext (accessed October 2019).
5. 药渡数据. https://data.pharmacodia.com/web/basic/basic_detail_PN1423.html (accessed October 2019).
6. Lily. https://investor.lilly.com/news-releases/news-release-details/lillys-reyvowtm-lasmiditan-first-and-only-medicine-new-class (accessed October 2019).
7. FDA Database. https://www.accessdata.fda.gov/drugsatfda_docs/label/2019/211280s000lbl.pdf (accessed October 2019).
8. 药渡数据:https://data.pharmacodia.com/web/basic/basic_detail_PB0264.html (accessed October 2019).
9. Novartis. https://www.novartis.com/news/media-releases/novartis-announces-fda-filing-acceptance-and-priority-review-brolucizumab-rth258-patients-wet-amd (accessed October 2019).
10. FDA Database. https://www.accessdata.fda.gov/drugsatfda_docs/label/2019/761125s000lbl.pdf (accessed October 2019).
11. 药渡数据:https://data.pharmacodia.com/web/basic/basic_detail_PC1697.html (accessed October 2019).
12. Vertex. https://www.trikafta.com/sites/default/files/2019-10/patient-brochure.pdf (accessed October 2019).
13. FDA Database. https://www.accessdata.fda.gov/drugsatfda_docs/label/2019/203188s029,207925s008lbl.pdf (accessed October 2019).
14. FDA Database. https://www.accessdata.fda.gov/drugsatfda_docs/label/2019/212273s000lbl.pdf (accessed October 2019).



合作咨询
![]() 肖女士
肖女士
![]() 021-33392297
021-33392297
![]() Kelly.Xiao@imsinoexpo.com
Kelly.Xiao@imsinoexpo.com
 2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57
2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57