https://www.cphi.cn 2022-02-06 11:27 来源:CPhI制药在线 作者:zhulikou431
随着2019年《药品管理法》的修订和实施,中国制药行业各项规章制度都处于全面重新构建状态。这其中,确保药品质量,确保行业合规体系平稳运行的GMP检查体系也被重新构建。
笔者不揣冒昧,汇总行业信息和最新法规指南,为各位同仁介绍中国GMP检查体系的最新情况。
第一部分:中国GMP检查过往回顾
2021年5月28日,国家局发布《药品检查管理办法(试行)》,对境内药品检查涉及的各项工作进行统一规定,并取代过去一直实施的GMP认证管理办法和GSP认证管理办法。本文在此部分梳理过去十多年间一直实施的GMP认证相关文件,供读者参考。
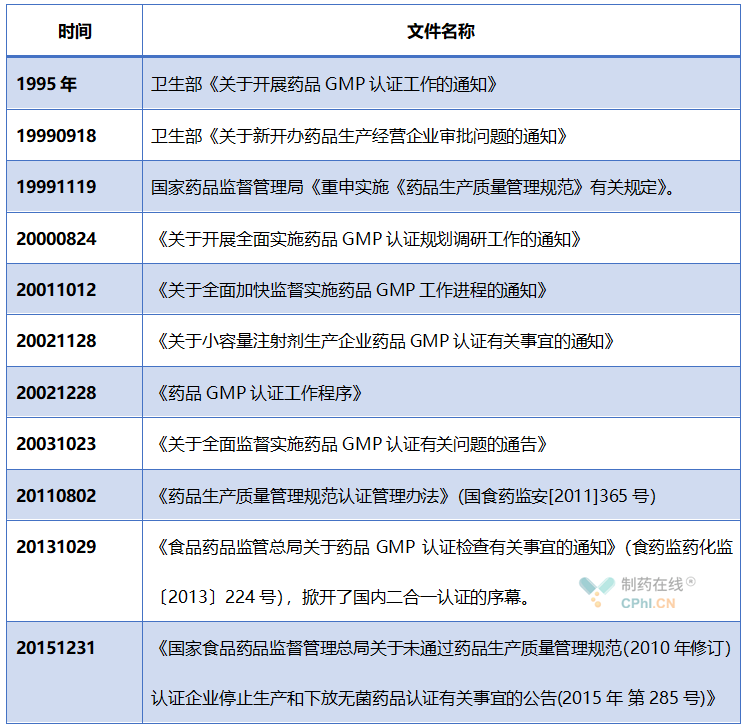
分析:通过上面表格中文件,可以看出:在过去多年,中国GMP认证和注册核查是平行进行的两条线;到2013年才开始二合一检查的试点工作。即使到今天,二合一程序是否实施,MAH也是有部分选择权的。在2015年底之前,中国GMP认证分为二级制度,其中国家局负责高风险品种的GMP认证检查,省局负责较低风险品种的GMP认证检查。自2016年1月1日开始,所有GMP检查任务都由省局负责落实和实施。
第二部分:中国GMP检查的最新法规和要求
◆《药品管理法》规定
2019年修订的《药品管理法》对GMP相关内容规定如下:
第四十三条 从事药品生产活动,应当遵守药品生产质量管理规范,建立健全药品生产质量管理体系,保证药品生产全过程持续符合法定要求。药品生产企业的法定代表人、主要负责人对本企业的药品生产活动全面负责。
第四十五条 生产药品所需的原料、辅料,应当符合药用要求、药品生产质量管理规范的有关要求。
第一百零三条 药品监督管理部门应当对药品上市许可持有人、药品生产企业、药品经营企业和药物非临床安全性评价研究机构、药物临床试验机构等遵守药品生产质量管理规范、药品经营质量管理规范、药物非临床研究质量管理规范、药物临床试验质量管理规范等情况进行检查,监督其持续符合法定要求。
第一百二十六条 除本法另有规定的情形外,药品上市许可持有人、药品生产企业、药品经营企业、药物非临床安全性评价研究机构、药物临床试验机构等未遵守药品生产质量管理规范、药品经营质量管理规范、药物非临床研究质量管理规范、药物临床试验质量管理规范等的,责令限期改正,给予警告;逾期不改正的,处十万元以上五十万元以下的罚款;情节严重的,处五十万元以上二百万元以下的罚款,责令停产停业整顿直至吊销药品批准证明文件、药品生产许可证、药品经营许可证等,药物非临床安全性评价研究机构、药物临床试验机构等五年内不得开展药物非临床安全性评价研究、药物临床试验,对法定代表人、主要负责人、直接负责的主管人员和其他责任人员,没收违法行为发生期间自本单位所获收入,并处所获收入百分之十以上百分之五十以下的罚款,十年直至终身禁止从事药品生产经营等活动。
◆《药品生产监督管理办法》规定
《药品生产监督管理办法》2020版对GMP规定如下:
第三条 从事药品生产活动,应当遵守法律、法规、规章、标准和规范,保证全过程信息真实、准确、完整和可追溯。从事药品生产活动,应当经所在地省、自治区、直辖市药品监督管理部门批准,依法取得药品生产许可证,严格遵守药品生产质量管理规范,确保生产过程持续符合法定要求。
……
原料药生产企业应当按照核准的生产工艺组织生产,严格遵守药品生产质量管理规范,确保生产过程持续符合法定要求。
第九条 省、自治区、直辖市药品监督管理部门应当自受理之日起三十日内,作出决定。
经审查符合规定的,予以批准,并自书面批准决定作出之日起十日内颁发药品生产许可证;不符合规定的,作出不予批准的书面决定,并说明理由。
省、自治区、直辖市药品监督管理部门按照药品生产质量管理规范等有关规定组织开展申报资料技术审查和评定、现场检查。
第十六条……
原址或者异地新建、改建、扩建车间或者生产线的,应当符合相关规定和技术要求,提交涉及变更内容的有关材料,并报经所在地省、自治区、直辖市药品监督管理部门进行药品生产质量管理规范符合性检查,检查结果应当通知企业。检查结果符合规定,产品符合放行要求的可以上市销售。有关变更情况,应当在药品生产许可证副本中载明。
第十九条 药品生产许可证有效期届满,需要继续生产药品的,应当在有效期届满前六个月,向原发证机关申请重新发放药品生产许可证。
原发证机关结合企业遵守药品管理法律法规、药品生产质量管理规范和质量体系运行情况,根据风险管理原则进行审查,在药品生产许可证有效期届满前作出是否准予其重新发证的决定。
第二十四条 从事药品生产活动,应当遵守药品生产质量管理规范,按照国家药品标准、经药品监督管理部门核准的药品注册标准和生产工艺进行生产,按照规定提交并持
续更新场地管理文件,对质量体系运行过程进行风险评估和持续改进,保证药品生产全过程持续符合法定要求。生产、检验等记录应当完整准确,不得编造和篡改。
第二十六条 从事药品生产活动,应当遵守药品生产质量管理规范,建立健全药品生产质量管理体系,涵盖影响药品质量的所有因素,保证药品生产全过程持续符合法定要求。
第三十五条 药品生产企业应当采取防止污染、交叉污染、混淆和差错的控制措施,定期检查评估控制措施的适用性和有效性,以确保药品达到规定的国家药品标准和药品注册标准,并符合药品生产质量管理规范要求。
第三十八条 药品上市许可持有人、药品生产企业应当每年进行自检,监控药品生产质量管理规范的实施情况,评估企业是否符合相关法规要求,并提出必要的纠正和预防措施。
第四十三条 药品上市许可持有人应当按照药品生产质量管理规范的要求对生产工艺变更进行管理和控制,并根据核准的生产工艺制定工艺规程。生产工艺变更应当开展研究,并依法取得批准、备案或者进行报告,接受药品监督管理部门的监督检查。
分析:根据上面两部重点法规的要求看,企业在药品上市后,必须严格执行GMP规范。这不仅是企业日常行为的准则,也是官方定期检查的准绳。
◆《药品检查管理办法(试行)》对GMP执行要求
在这份文件中,根据检查性质和目的,药品检查分为许可检查、常规检查、有因检查、其他检查。其中涉及GMP检查的类型包括许可检查、常规检查和有因检查。
第三部分:各省GMP检查文件最新情况梳理
到目前为止,共有6个省级局发布了针对GMP检查实施的具体文件。详细情况参见下表:

通过阅读和梳理上面表格中提到的文件,可以看出如下特点:
◆从上面文件题目可以看出,部分省局配套文件已经是定稿文件;而部分省局文件是在国家局发布《药品检查管理办法》之后发布的综合配套文件,还处于征集意见阶段。
◆从发布时间看,吉林省局的文件是在国家局发布《药品检查管理办法》之前发布的,只涉及GMP检查规定,内容还不全面,应该后续还会出台配套文件。
◆辽宁省局的文件,整体布局和国家局文件相一致;但是对于哪些检查需要采用GMP标准,写的不是很明确。而河南省局在这个方面相对较好,对于哪些检查需要执行GMP标准,说的比较具体。
总结
综上所述,在2019年《药品管理法》修订和实施后,新的药品检查和监督体系在重新构建。尽管国家局已经发布了《药品检查管理办法》,一些省局也逐步发布和落实配套文件;然而,从整体工作进度看,很多省局对于重新构建检查体系的工作思路还不清晰,还在研究过程中。预测2022年下半年这项工作会基本完成。
参考文献
1- NMPA官网信息
2- 各省局官网信息
作者简介:zhulikou431,高级工程师、PDA会员、ISPE会员、ECA会员、PQRI会员、资深无菌GMP专家,在无菌工艺开发和验证、药品研发和注册、CTD文件撰写和审核、法规审计、国际认证、国际注册、质量体系建设与维护领域,以及无菌检验、环境监控等领域皆具有较深造诣。近几年开始着力关注制药宏观领域趋势分析和制药企业并购项目的风险管理工作。
版权所有,未经允许,不得转载。
投稿合作联系方式: Kelly.Xiao@imsinoexpo.com 021-33392297
地址:上海市徐汇区虹桥路355号城开国际大厦7-8楼 200030