https://www.cphi.cn 2024-03-07 18:27 来源:CPHI制药在线 作者:忆
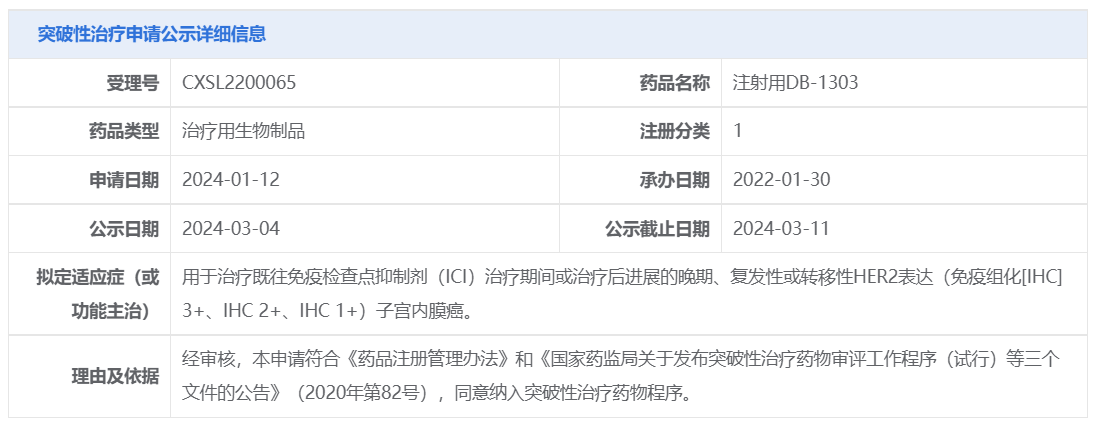
3月4日,映恩生物制药(苏州)有限公司1类新药「注射用DB-1303」被CDE纳入突破性治疗品种,用于治疗既往免疫检查点抑制剂(ICI)治疗期间或治疗后进展的晚期、复发性或转移性HER2表达(免疫组化[IHC] 3+、IHC 2+、IHC 1+)子宫内膜癌。
DB-1303是映恩生物基于其独创的抗体偶联药物(ADC)平台开发的新一代HER2靶向ADC,由抗HER2单克隆抗体、可剪切连接子和专有的拓扑异构酶I抑制剂P1003(DB-1303具有抗肿瘤活性强、安全性好和治疗指数宽等特点)组成。
2023年12月,DB-1303被FDA授予突破性疗法认定,用于治疗在免疫检查点抑制剂治疗期间或之后出现进展的晚期子宫内膜癌患者。而FDA此举是基于DB-1303治疗HER2表达晚期/转移性实体瘤的1/2a期临床试验结果。
该研究子宫内膜癌队列共入组32例患者,其中90.6%仍在接受治疗,既往治疗线数的中位数为2。已公布的研究结果显示:在17例接受7.0mg/kg或8.0mg/kg剂量DB-1303治疗的可评估患者中,总体客观缓解率(ORR)为58.8%,疾病控制率(DCR)为94.1%。安全性方面,研究中最常见的TEAE包括恶心、呕吐和疲乏,未观察到导致永 久停药的TEAE以及与研究药物相关的SAE。
此次DB-1303被CDE纳入突破性治疗品种,将加速其子宫内膜癌适应症在国内的进程。此外,DB-1303还被开发用于治疗乳腺癌,包括既往接受过曲妥珠单抗和紫杉烷类治疗的HER2阳性不可手术切除/转移性乳腺癌、接受内分泌治疗后出现疾病进展的HER2低表达、激素受体阳性转移性乳腺癌。
HER2靶向ADC进展
HER2是抗体偶联药物(ADC)研发的热门靶点,目前全球已获批3款HER2靶向ADC,即Kadcyla(ado-trastuzumab emtansine,T-DM1)、Enhertu(trastuzumab deruxtecan,T-DXd)和维迪西妥单抗(RC48)。
Kadcyla是罗氏开发的一款ADC,由HER2靶向赫赛汀与微管蛋白抑制剂美 坦新(DM1)通过稳定的不可剪切连接子MCC连接而成。目前,Kadcyla已获批多项适应症:既往接受过赫赛汀及一种紫衫类药物治疗的HER2阳性、不能手术切除的局部晚期或转移性乳腺癌(2013.02);接受新辅助(术前)治疗后存在残留浸润性疾病的HER2阳性早期乳腺癌(eBC)患者的辅助(术后)治疗(2019.05)。
Enhertu是第一三共与阿斯利康合作开发的新一代ADC,由4肽链接子、HER2靶向人源化单抗trastuzumab(曲妥珠单抗)和拓扑异构酶1抑制剂exatecan衍生物(DX-8951衍生物,DXd)偶联而成。目前,该药已在美国获批多项适应症:既往接受过曲妥珠单抗治疗失败的、HER2阳性、局部进展期或转移性胃或胃食管交界部腺癌的成人患者(2021.01);既往在转移性、新辅助治疗或辅助治疗时,接受抗HER2治疗期间或治疗结束6个月内疾病复发的、不可切除的或转移性HER2阳性乳腺癌成人患者(2022.05);在转移性疾病阶段既往接受过系统化疗,或在辅助化疗期间或完成辅助化疗后6个月内出现疾病复发的,不可切除的或转移性HER2低表达(IHC 1+或IHC 2+/ISH-)乳腺癌成人患者(2022.08);既往接受过系统治疗的HER2突变、不可切除或转移性非小细胞肺癌成人患者(2022.08)。此外,Enhertu用于治疗不可切除或转移性HER2阳性(免疫组化[IHC] 3+)实体瘤成年患者的sBLA正在美国接受优先审查。
维迪西妥单抗(RC48)是荣昌生物开发的一款HER2靶向ADC,2021年6月被NMPA批准用于至少接受过2种系统化疗的HER2过表达局部晚期或转移性胃癌(包括胃食管结合部腺癌),2022年1月被NMPA批准用于既往接受过系统化疗、HER2表达为免疫组化检查结果为2+或3+的局部晚期或转移性尿路上皮癌。
这几款药物中,Enhertu表现最 佳,不仅获批适应症最多,销售额也最高,2023约为25.66亿美元。值得一提的是,2023年Enhertu销售额反超Kadcyla,Kadcyla 2023年销售额约为19.66亿瑞士法郎(约为22.22亿美元)。作为首 个获批的国产ADC,维迪西妥单抗市场表现也不错,2022年销售额为4.12亿元。
此外,目前全球还有多款HER2靶向ADC处于临床后期,如Byondis的SYD985、科伦博泰的A166、恒瑞医药的SHR-A1811、石药集团的DP303c(SYA1501)。
SYD985是Byondis利用其专有的基于duocarmazine的连接子药物技术(LD)平台ByonZine开发的新一代HER2靶向ADC,由曲妥珠单抗和可切割的linker-drug缬氨酸-瓜氨酸-seco-DUocarmycin-hydroxyBenzamide-Azaindole(vc-seco-DUBA)组成。遗憾的是,2023年5月,该药用于治疗HER2阳性乳腺癌的生物制品许可申请惨遭FDA拒批。
A166是科伦博泰研发的HER2靶向ADC。2022年ASCO年会公布的A166针对经多线治疗的HER2阳性乳腺癌患者的1期剂量扩展研究的数据显示:4.8mg/kg组客观缓解率(ORR)达73.9%,中位无进展生存期(PFS)达12.3个月。2023年5月,A166治疗既往经过二线及以上抗HER2治疗失败的HER2阳性不可切除的局部晚期、复发或转移性乳腺癌的上市申请获CDE受理。
SHR-A1811是恒瑞医药自主研发的HER2靶向ADC,目前已进入3期临床。值得一提的是,SHR-A1811五项适应症被CDE纳入突破性的治疗品种:HER2低表达的复发或转移性乳腺癌;HER2阳性的复发或转移性乳腺癌;既往含铂化疗失败的HER2突变的晚期非小细胞肺癌;既往经奥沙利铂、氟尿嘧啶和伊立替康治疗失败、HER2阳性结直肠癌;既往至少一线抗HER2治疗失败的HER2阳性晚期胃癌或胃食管结合部腺癌。
DP303c(SYA1501)是由石药集团中奇制药技术开发的ADC,由一个对HER2有高度选择性的抗体和细胞毒素MMAE偶联而成,被开发用于治疗HER2阳性乳腺癌、胃癌、卵巢癌等。2021年1月,该药对比T-DM1治疗HER2阳性且既往经曲妥珠单抗和紫杉烷类治疗的不可切除局部晚期或转移性乳腺癌的有效性和安全性的3期临床研究启动。
总结
HER2是肿瘤药物研发的热门靶点,也是ADC研发热门靶点。目前,HER2靶向ADC已取得不错进展,获批药物数量达三款,获批适应症覆盖乳腺癌、胃癌、尿路上皮癌、非小细胞肺癌。此外,全球还有多款HER2靶向ADC进入临床后期。值得一样的是,我国药企在HER2靶向ADC领域的表现也是可圈可点,除了荣昌生物,石药集团、恒瑞医药、科伦博泰也将迎来收获,其ADC已进入3期临床。期待HER2领域有更多的ADC获批上市,造福众多相关肿瘤患者。
版权所有,未经允许,不得转载。
投稿合作联系方式: Kelly.Xiao@imsinoexpo.com 021-33392297
地址:上海市徐汇区虹桥路355号城开国际大厦7-8楼 200030