自从90 年代初第一个科学性突破的抗偏头痛药物舒马曲坦问世以来,曲坦类药物引领并驱动了全球抗偏头痛药物市场的增长。在2005年时,全球抗偏头痛药物市场就已达35亿美元。近年来,因尚无具有突破性的抗偏头痛药物问世,加之已获批上市的7个曲坦类药物先后遭遇专利悬崖,全球抗偏头痛药物市场呈下降趋势。2015年统计的偏头痛品牌药中,尚无一款药物销售额突破十亿美元。因此迫切期待出现新的抗偏头痛领军品种以重振雄风。
另外,抗偏头痛药物病理机制尚未完全阐明,因此目前尚无可完全治愈偏头痛的药物。曲坦类药物是唯一一种针对偏头痛开发的药物,但不能用于间歇期的预防性治疗,仍存在着未满足的临床需求。
基于目前对于偏头痛的病理机制和上市药物的认知,我们应该以怎样的新要求来面对抗偏头痛药物的开发,是值得我们深入思考的。幸运的是,FDA在2018年2月发布了新的急性偏头痛药物开发指南《Migraine: Developing Drugs for Acute Treatment》供我们参考。笔者基于原文梳理了指南内容,以便于读者理解指南精髓。
指南介绍
1. 指南说明
本指南旨在协助申请人临床开发治疗急性偏头痛的处方药,但不适用于OCT类药物。
本指南不涉及减少偏头痛发作频率药物的开发,该类药物开发指南将会在未来单独发布。
本指南提出了FDA支持治疗急性偏头痛处方药批准的总体开发计划和当前的临床试验设计思路。
2. 偏头痛特点
偏头痛是一种慢性神经血管性疾病,其特征在于经常出现反复发作的中重度头痛,并经常伴有恶心、对光和/或声音敏感等症状。偏头痛通常是搏动性的、单侧的、并且会伴随体力活动而加重。在成年人中,偏头痛发作通常会持续4至72小时。
3. 偏头痛的诊断和分类
国际头痛协会(IHS)指出,应在至少5次发作中结合其中的相关特征和症状来确诊偏头痛。
偏头痛有两种主要的亚型:无先兆偏头痛(普通偏头痛)和先兆性偏头痛(经典偏头痛)。先兆性偏头痛的特征是典型的局部神经症状,或有时伴随头痛。这些局部神经症状在无先兆偏头痛中不存在。有些患者可能会同时出现两种亚型的偏头痛。
治疗偏头痛的药物包括治疗急性偏头痛发作的药物(急性偏头痛的治疗)和减少偏头痛发作频率的药物(预防性治疗)。本指南仅涉及治疗急性偏头痛发作药物的开发。
4. 开发计划
(1)受试人群
I期临床试验可以招募健康成人志愿者或偏头痛患者。但值得注意的是,由于偏头痛患者主要为女性,所以在早期开发阶段(即II期临床试验开始时)招募正在实行有效避孕措施的育龄妇女也是很重要的。
由于偏头痛的发病高峰期是青春期,而且幼童的发病并不少见,因此FDA要求针对儿童进行儿科用药研究。由于申请人需要在II期临床试验会议结束后的60天内提交儿科研究计划,因此鼓励申请人在开发早期就开始讨论儿科临床开发计划。
(2)有效性考虑
通常至少需要两个充分和良好控制的试验来支持新分子实体的批准。
对于已批准的急性偏头痛治疗药物,单独的良好对照试验可以用于支持新治疗亚群(例如,用于儿科人群)和新给药途径药物的批准。(具体参见行业指南《Providing Clinical Evidence ofEffectiveness for Human Drug and Biological Products》)。
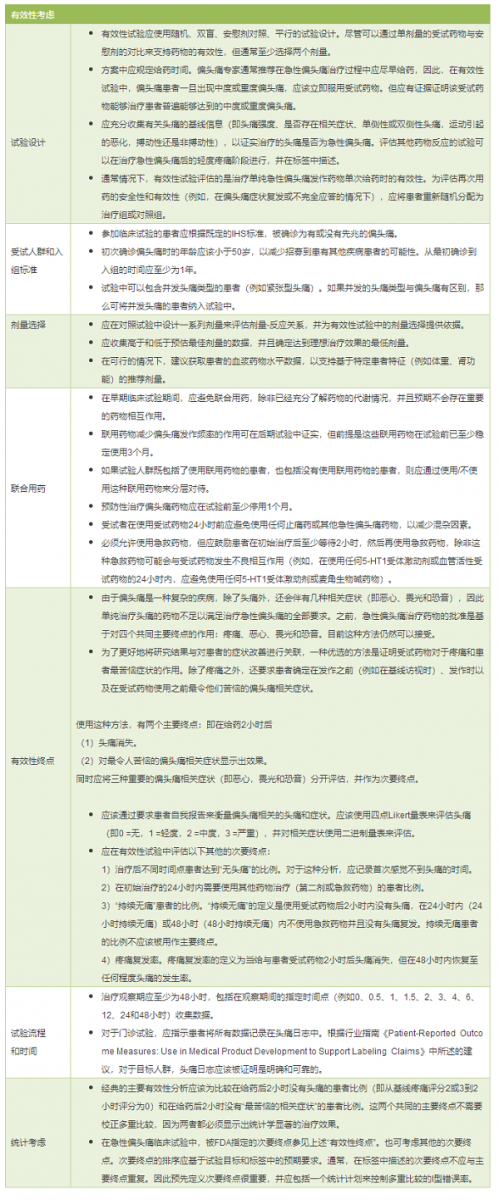
(3)安全性考虑
急性偏头痛可以采取长期治疗和间歇治疗。因此,治疗急性偏头痛的受试药物获批上市所需的安全性数据应与慢性治疗药物的要求相一致,包括至少进行一项长期安全性试验,在此期间患者可以使用受试药物治疗所有急性偏头痛发作。
由于III期临床试验通常在门诊就诊,因此I期和II期临床试验是在严格的医疗监督下进行的,这是受试药物获得生命体征和实验室数据的机会。这些试验应包括生命体征、血液学、血清化学、尿液分析和12导联心电图。对于受试药物和主要代谢物,应围绕着预期Cmax来评估生命体征和心电图。在大多数短期II期和III期门诊试验中,应进行基线和治疗后的生命体征和实验室评估。考虑到非临床研究结果以及对受试药物和其他类药物的早期人体用药经验,应在适当的时间间隔内获得III期临床试验的长期安全性数据。
新分子实体应遵循ICH工行业指南中的安全建议《E1A The Extent of Population Exposure to Assess Clinical Safety: For DrugsIntended for Long-Term Treatment of Non-Life-Threatening Conditions》。为计入长期安全性数据库,成人患者平均每月应至少治疗两次偏头痛发作。安全性经验应当建立在此相关的剂量和给药频率上。
如果药物存在潜在的不良血管影响,可能需要进行额外的非临床研究(例如评估冠状动脉血管收缩的体外研究)和危险人群(例如已知冠状动脉疾病的患者)安全性研究。建议在开发计划的早期与相关部门进行磋商。
(4)其他考虑
①儿科研究
偏头痛是儿童中相对常见的疾病。有理由相信成人和儿科人群中的偏头痛是完全不同的,并且不能认为对成人有效的药物对儿童也有效。因此,需要在儿科人群中进行研究。
由于偏头痛在6岁以下的儿童中很少见,因此通常会豁免针对这个年龄段的研究。儿科研究应针对评估6至17岁的患者。由于疾病特征会随着青春期的变化而变化,儿科研究应该包括足够数量的患者来描述整个儿科年龄范围内药物的安全性和有效性。
偏头痛诊断应基于IHS标准。建议申请人参考基于2017年FDA重新授权法修订的儿科研究平等法案,以审查提交的初始儿科研究计划。
在临床有效性试验开始之前,应评估药物在儿科人群中的药代动力学特征,并与药物在成人中的药代动力学特征进行比较。这有助于选择正确的剂量用于儿科有效性和安全性研究。还应根据需要来考虑设计适合相应年龄段的制剂。
申请人可以考虑以下两种方案来进行儿科有效性研究:
(1)将12至17岁儿科患者和6至11岁儿科患者分开进行有效性研究(每组患者均能显示出有效性)。
(2)对6至17岁的患者进行单独的有效性研究,应招募足够数量的6至11岁和12至17岁亚组患者来充分评估药物在每个亚组中的有效性(和安全性),但不需要在每个亚组中达到统计学显著性差异。
由于儿童偏头痛研究中的安慰剂反应率高,因此应考虑采用富集策略来增加证明药物作用的机会。在一些儿科临床试验中成功的方法是,在偏头痛发作期间,首先给予所有患者单盲安慰剂,然后将仅在30分钟时没有消除疼痛的患者随机分配给与受试药物或安慰剂。
给予受试药物2小时后疼痛消除的患者比例应为主要终点。儿科研究不需要评估疼痛和其他症状(即共同主要终点)。应将偏头痛相关症状评估作为次要终点。上述成人临床试验的其他次要终点也应进行评估,并再次控制I型错误率。
应进行为期一年的儿科长期安全性研究。一般而言,如果该药物已批准用于成人,儿科安全数据库至少应包括200名患者每个月治疗偏头痛发作的数据,持续6个月;75名患者每个月至少治疗一次偏头痛发作的数据,持续1年。
该研究应评估治疗对生长、认知和内分泌发育的影响。在开展长期儿科安全性研究之前,应对单一物种(通常为大鼠)进行幼年动物毒理学研究。
②标签注意事项
在过去的二十年里,FDA批准了几种治疗急性偏头痛的新药,并在美国上市销售。其中大多数是选择性5-HT1B/1D受体激动剂,即曲坦类药物。
曲坦类药物的主要安全性问题为其引起冠状动脉或外周动脉狭窄的能力,这可能导致严重的不良心脏或外周血管事件。因此,FDA已对曲坦类药物采用了某些标准或分类标签。未来具有相似药理学活性的研究药物将受到此类标签的限制,除非可以证明药物不具有血管收缩作用。此外,具有潜在血管收缩作用其他药物类别的新药可能也会获得类似的标签。
最新批准的此类药物标签应该成为具有类似作用机制或类似安全性问题(例如冠状血管收缩)新药的标签基础或模板。与通常一样,即使本指南中未描述,有关安全使用药物的其他信息也应包含在适当的标签章节中。
以下标签部分的建议适用于所有用于治疗偏头痛的新药。
适应症和用法:这部分应该是简短的,并且应该说明药物被指示用于有或没有先兆的急性偏头痛治疗。
用法用量:本部分应包括以下信息:1)治疗相同急性偏头痛发作的两剂之间的最小时间间隔(即如果服药后2小时内,偏头痛发作没有解决,或者在短暂改善后复发)。只有在上市申请中包含支持再次给药的安全性和有效性的信息时,才需要在标签中描述再次给药的相关信息。2)在30天安全治疗周期内,急性偏头痛发作的平均次数(根据长期安全性试验获得的数据)。
警告和注意事项,本部分应包括头痛药物的滥用,描述如下:1)头痛药物滥用。滥用急性偏头痛药物(例如,每月使用10天或更长时间的麦角胺、曲坦类药物、阿 片类药物或药物组合)可能导致头痛恶化(即药物滥用性头痛)。滥用头痛药物可能表现为类似偏头痛的每日头痛或偏头痛发作频率显著增加。2)可能需要对患者进行戒断,包括戒断滥用的药物和治疗戒断症状(通常包括短暂性头痛的恶化)。
临床研究。本节应描述从有效性试验中获得的有效性证据。本部分应包括一个使用Kaplan-Meier生存分析方法得出的图表,以显示使用初始剂量后2小时内产生初始头痛反应的估计概率。来自类似设计的对照试验的有效性数据可用于生成这些图表。如果有剂量-反应数据,应显示这些数据。还应包括描述药物剂量-反应关系的简要说明,以及有关重要亚组(例如性别、年龄和种族)有效性的简要说明。
参考文献
1.Guidance for Industry-Migraine: Developing Drugs for Acute Treatment. 2018.2
2.雷诺岛. 偏头痛药物全球销售下滑国内市场有望持续增长. 医药经济报. 2017年7月10 日/第F02版








合作咨询
![]() 肖女士
肖女士
![]() 021-33392297
021-33392297
![]() Kelly.Xiao@imsinoexpo.com
Kelly.Xiao@imsinoexpo.com
 2006-2024 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57
2006-2024 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57