序言
近年来,随着CFDA大刀阔斧的改革:仿制药一致性评价、新的药品注册分类、MAH制度的落地等;这些除旧布新的药品监管政策正在打破一个旧的世界,建立一个新的未来。中国正处于万众创新的大环境,新药研发在各种政策支持下,也越发显得活跃。本系列文章将介绍小分子新药口服固体制剂的开发技术和流程。
处方前研究
一旦一个新苗头化合物通过一系列细胞和动物试验,初步确认其有较好的生物活性后,即可开始着手准备临床试验的申请。由于临床试验是在人体上进行相关有效性、安全性的评价,故其需要开发合适的给药途径和剂型,即新药制剂的开发。在正式开始制剂处方、工艺开发之前,需要对新化合物的主要性质进行考察,即处方前研究。
成盐性和多晶型
新化合物的固体形态(盐型和晶型)会影响其稳定性、溶解性、溶出速率、临床疗效和制剂的处方工艺等。由于化合物一般为游离酸或碱,其往往溶解度较差,影响生物利用度,所以需要对新化合物进行盐筛。在开始筛盐之前需要明确成盐的目的:是为了改善溶解度和生物利用度,还是为了提高产品的稳定性、工业化可开发性等;然后通过相关目标的评价指标进行筛选。当新化合物或其盐的溶解度和生物利用度均满足要求,此时需要进一步筛选其晶型,以便选出稳定性和工业化可开发性的优势晶型。新化合物盐型和晶型筛选、评估流程如下图:
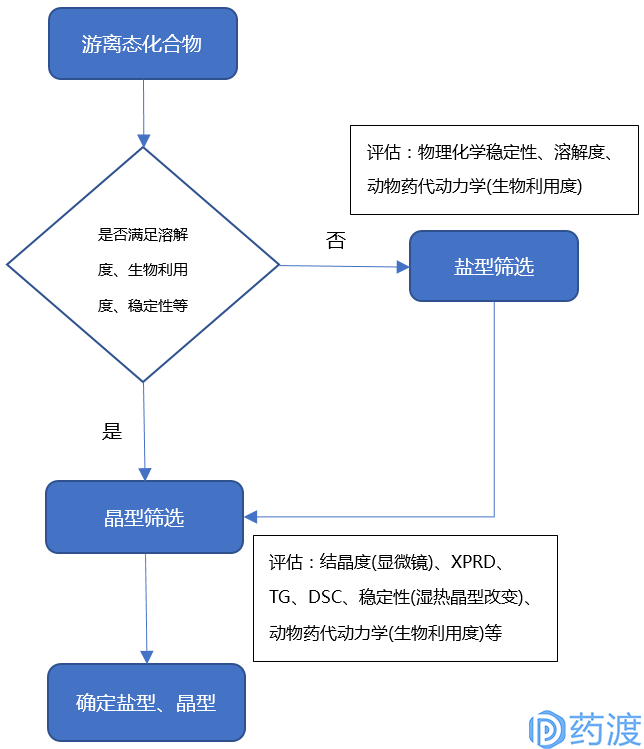
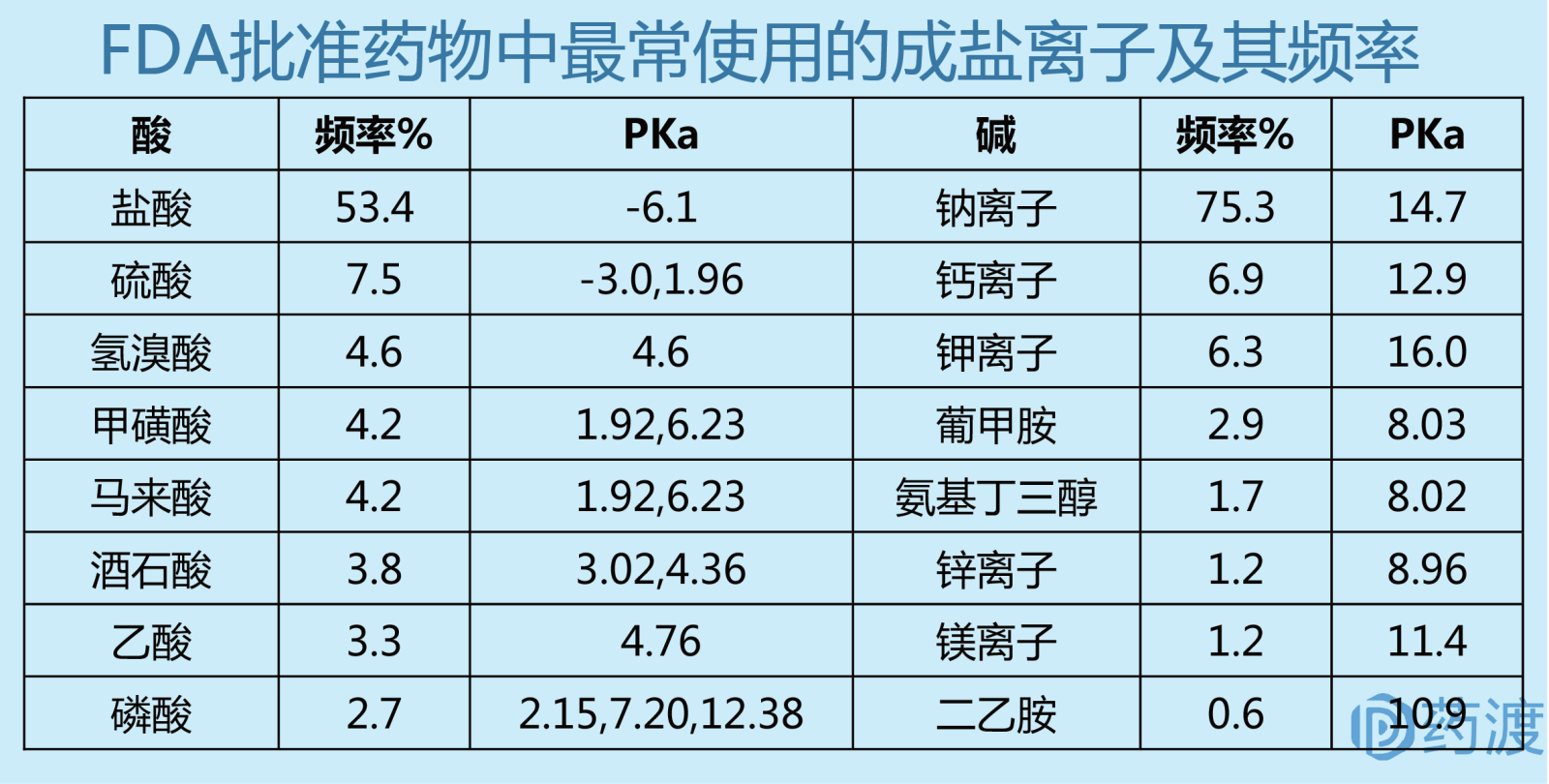
盐型比游离酸(碱)具有更高的初始溶解度和吸收速度,即使溶解后的盐型在生理PH条件下盐型会变成游离酸(碱)沉淀,但该沉淀过程可产生细小的无定型沉淀,导致更高的初始溶出和吸收速度。成盐的反离子应与相应化合物的PKa相差大于2,一般2-3为宜,这样保证盐型的溶解度远大于游离化合物。使用FDA已批准过的反离子,否则需要提供反离子的完整毒理学数据。
溶解度和溶液稳定性
药物发现阶段,为了增强与靶蛋白结合能力,化合物一般具备较强的亲脂性,所以在药物开发的后期,化合物溶解度往往是比渗透性大得多的问题,低溶解度往往会导致差的生物利用度。对于确定晶型和盐型的化合物需要测定其PH-溶解度曲线,以便为制剂处方工艺的开发策略提供指导。FDA指南《Waiver of In Vivo Bioavailability and Bioequivalence Studies for Immediate-Release Solid Oral Dosage Forms Based on a Biopharmaceutics Classification System Guidance》提供了化合物PH-溶解度曲线试验方法:

同时,为了解析化合物在不同生理PH条件下的稳定性,需考察PH 1-6.8介质下化合物的溶液稳定性,具体可参考ICH Q1。
通过测定不同生理PH条件下的溶解度,判断化合物溶解度是否为PH依赖型,溶解度是否满足BCS分类对高溶解度的定义;如是低溶解性化合物,可能制剂开发需要考虑API微粉化或添加增溶剂。同时通过PH-溶解度曲线和溶液稳定性试验,可以为制剂溶出条件和制剂开发提供帮助,如溶出PH条件的选择,是否需要添加表面活性剂,是否需要做成肠溶片等。
解离和PKa
绝大多数化合物含有可离子化基团,在水溶液中,部分化合物离子化变成离子化化合物,PKa显示了化合物在水中的离子化能力。
酸性化合物:
HA=H++A-
PKa= -log([H+] [A-]/[HA])
PH= PKa+log([A-]/[HA])
碱性化合物:
HA+=H++B
PKa= -log([H+] [B]/[HB+])
PH= PKa+log([B]/[HB+])

根据相似相容原理,离子化化合物在水中溶解度高,有机相溶解度低;游离化合物则相反。化合物的解离以相反方向同时影响其溶解度和渗透性,进而影响化合物的生物利用度。通过PKa测定,可以了解化合物在体内的溶解、渗透过程,为合理开发制剂提供参考。PKa也会影响成盐离子的选择,可以根据PKa选择适当的成盐形式,成盐的反离子应与相应化合物的PKa相差大于2,一般2-3为宜,这样保证盐型的溶解度远大于游离化合物。
亲脂性和log P (Log D)
新化合物需要具有合适的亲脂性才能穿过细胞膜的脂质双分子层,尤其化合物主要是通过被动扩散渗透。亲脂性评估一般通过Log P或Log D来表示。
Log P:在化合物的所有分子均以中性形式存在的PH条件下,其在一种有机相(如正辛醇)和一种水相(如缓冲液)中分配系数的对数即LogP。
Log P = Log([化合物有机相]/[化合物水相])
Log D:某一特定的PH(x)下,化合物部分以离子形式存在,部分以中性分子形式存在;此PH下的化合物在一种有机相和一种水相中分配系数的对数即为Log D。
Log DPH = Log([化合物有机相]/[化合物水相])

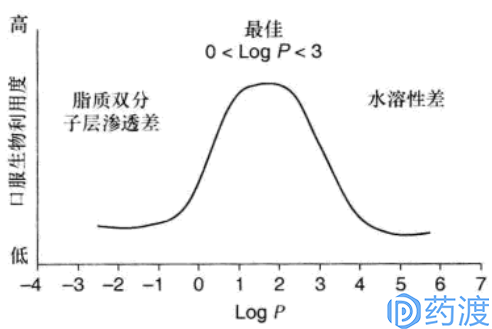

在药物开发的早期阶段,为提高化合物与靶标蛋白的结合能力,一般新药的脂溶性问题不大。如若化合物亲脂性较低,制剂开发可考虑制备成脂质体等剂型。
渗透性
渗透性是药物通过某个生物膜屏障的速度,其是药物发挥作用的必要过程。渗透性机制一般包括被动扩散、主动转运、胞吞、外排和细胞旁路,其中被动扩散占主要机制。被动扩散是浓度梯度驱动,化合物总是从高浓度区向低浓度区转移。在被动扩散转移过程中,化合物必须通过高度非极性的脂质双层膜,故亲脂性化合物的渗透性更高。基于上述原因,生理体系的PH和化合物的PKa在被动扩散中起着重要作用。酸性化合物在PH<PKa环境下以游离态为主,其被动扩散强;在PH>PKa环境下以离子态为主,其被动扩散弱;碱性化合物反之。
化合物渗透性一般可通过平行人工膜渗透性测定(PAMPA)、Caco-2细胞法;吸收收完全的药物具有较高的表观渗透系数(Papp>1×10-6) 而吸收不完全的药物的渗透系数则较小(Papp< 1×10-7) 。如果药物的渗透性较差,则在制剂过程中需要考虑添加吸收促进剂。
化合物的强制降解试验和稳定性试验
由于制剂的处方工艺开发主要涉及的是物理变化,除了可能存在的原辅料的配伍禁忌外,制剂的稳定性主要有化合物的稳定性决定。实践过程中一般考察化合物的强制降解实验(酸、碱、光照、强氧化剂等)和稳定性实验来积累新化合物的化学稳定性数据。新化合物稳定性考察可参考ICH Q1 A、ICH Q1 B。
小结
新化合物处方前研究对制剂处方开发意义重大。通过对新化合物的理化性质的深入研究,发现并总结新化合物的特性,
参考文献:
1.生物药剂学在药物研发中的应用
2.安塞尔药物剂型给药系统
3.类药性质:概念、结构设计与方法
4.固体口服制剂的研发
5.应用生物药剂学与药物动力学
6.药物生物利用度








合作咨询
![]() 肖女士
肖女士
![]() 021-33392297
021-33392297
![]() Kelly.Xiao@imsinoexpo.com
Kelly.Xiao@imsinoexpo.com
 2006-2024 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57
2006-2024 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57