5月16日,华北制药发布企业公告消息称,其下属新药公司收到国家药品监督管理局核准签发的奥木替韦单抗注射液(200IU(1ml)/瓶)的《药品补充申请批准通知书》。
奥木替韦单抗注射液补充申请内容:
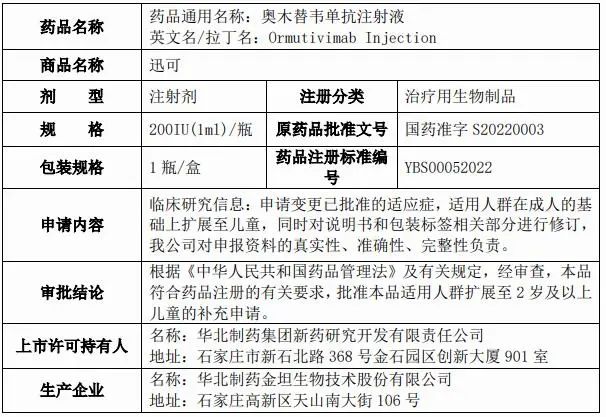
图片来源:华北制药企业公告
奥木替韦单抗注射液为重组人源抗狂犬病毒单抗注射液,国际非专利通用名称为Ormutivimab,中文通用名称为奥木替韦单抗。
奥木替韦单抗注射液是新药公司自主研发项目,其作用机制及适应症为将本品与人用狂犬病疫苗联用,用以补充人用狂犬病疫苗主动免疫过程中的抗体空白,可直接中和体内狂犬病毒,起到被动免疫作用,用于被狂犬或其它狂犬病毒易感动物咬伤、抓伤患者的被动免疫。新药公司奥木替韦单抗注射液(200IU(1ml)/瓶)已于 2022年 1 月获批上市,本次申请为变更已批准的适应症,适用人群在成人的基础上扩展至儿童。
奥木替韦单抗注射液扩展儿童适用人群的补充申请于2023年1月获得国家药品监督管理局药审中心受理,2023 年 6 月完成药品注册临床试验现场核查。2024 年5 月,国家药品监督管理局根据《中华人民共和国药品管理法》及有关规定,批准本品适用人群扩展至 2 岁及以上儿童。
截至目前,奥木替韦单抗注射液扩展儿童适用人群项目的累计研发投入 2008.77 万元人民币。
国内可用于狂犬病毒暴露后预防的被动免疫制剂为抗狂犬病血清和狂犬病人免疫球蛋白,以及奥木替韦单抗注射液 200IU(1ml)/瓶。通过国家药品监督管理局网站数据查询结果显示,截至当前国内有 19 家企业具有狂犬病人免疫球蛋白批准文号,未批准进口产品销售。根据中检院、共研网生物制品批签发数据显示,狂犬病人免疫球蛋白(规格:200IU/瓶)2022年批签发数量约为 1263.89 万瓶;根据药渡网查询显示,狂犬病人免疫球蛋白 2022 年的各地中标价(200IU/瓶)在 140~199 元/瓶。华北制药未能从公开渠道查询到上述产品的市场销售数据。
通过国家药品监督管理局药品审评中心网站查询显示,目前国内除新药公司以外,兴盟生物医药(苏州)有限公司的泽美洛韦玛佐瑞韦单抗注射液已申报上市;智翔(上海)医药科技有限公司/重庆智翔金泰生物制药有限公司开发的 GR1801 注射液正在进行Ⅲ期临床试验;长春百克的 CBB1注射液正在开展Ⅰ期临床试验;兰州生物制品研究所有限责任公司的重组人源抗狂犬病毒单克隆抗体注射液正在申报临床。
国外,印度血清研究所研发的重组抗狂犬病毒单抗注射液 SII RMab(Rabishield)已于 2016 年 12 月在印度批准上市;印度 Zydus Cadila 开发的鼠源单抗混合制剂 RabiMabs(Twinrab)于 2019 年 9 月在印度获得批准。公司未能从公开渠道查询到上述公司关于该产品的市场销售数据。



合作咨询
![]() 肖女士
肖女士
![]() 021-33392297
021-33392297
![]() Kelly.Xiao@imsinoexpo.com
Kelly.Xiao@imsinoexpo.com
 2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57
2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57