
图片来源:普利制药企业公告
根据公开数据显示,钆特酸葡胺注射液2023年的市场容量为5.9亿元,其中城市公立为5.1亿元(占所有销售终端销售额的86.71%)。钆特酸葡胺5年复合增长率13%,增长势头迅猛。此次普利制药钆特酸葡胺注射液的获批将对公司的业绩产生积极影响,有望带来持续的业绩增长!
钆特酸葡胺在核磁共振造影剂领域属于第二大市场,而第一大市场为钆喷酸葡胺。钆喷酸葡胺为线性含钆造影剂,钆特酸葡胺为环状含钆造影剂。2017年7月21日,考虑到钆剂脑内沉积风险,欧洲药品管理局(EMA) 正式限制了部分线性钆对比剂的使用,其中包括钆喷酸葡胺。国家药品监督管理局也发布了药物警戒信息。
国家药品监督管理局对钆喷酸葡胺的药物警戒
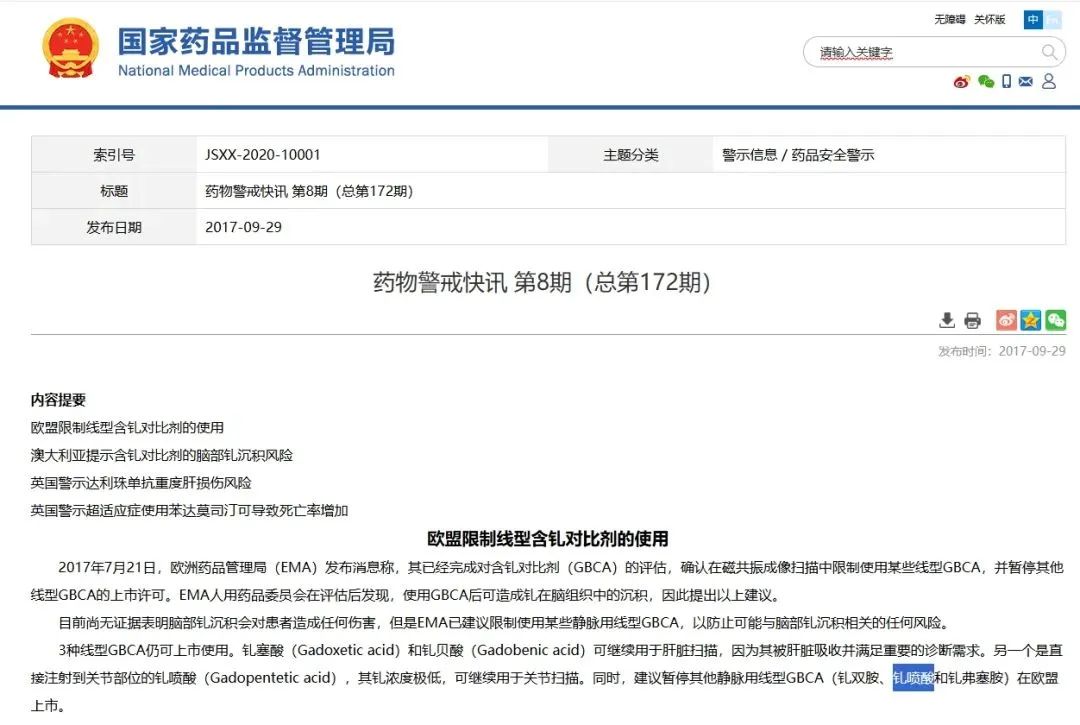
图片来源:国家药品监督管理局
环状含钆造影剂对线性含钆造影剂的替代成为市场趋势。若纳入对钆喷酸葡胺的市场迭代,钆特酸葡胺注射液将有更大的市场预期。
钆特酸葡胺注射液是一种造影剂,由法国GUERBE 药业研发,最早于1989 年获法国批准上市,2011年以商品名“多它灵”进入中国市场,规格为10ml:3.769g、15ml:5.6535g、20ml:7.538g,2013年3月FDA批准Guebert的钆特酸葡胺注射液(商品名:Dotarem)进入美国市场,规格为1.8845g/5mL、3.769g/10mL、5.6535g/15mL、7.538g/20mL和37.69g/100mL。
普利制药钆特酸葡胺注射液此次中国获批5个规格,分别为:5ml:1.8845g、10ml:3.769g、15ml:5.6535g、20ml:7.538g、100ml:37.69g(以钆特酸葡胺计),与原研Guebert的美国获批规格一致,能全面满足临床不同患者核磁共振增强检查项目需要,丰富了国内的规格,能全面满足临床不同检查项目需要,避免药物的浪费或不足,实现精准给药需求。
美国FDA官网原研加柏获批的5个规格
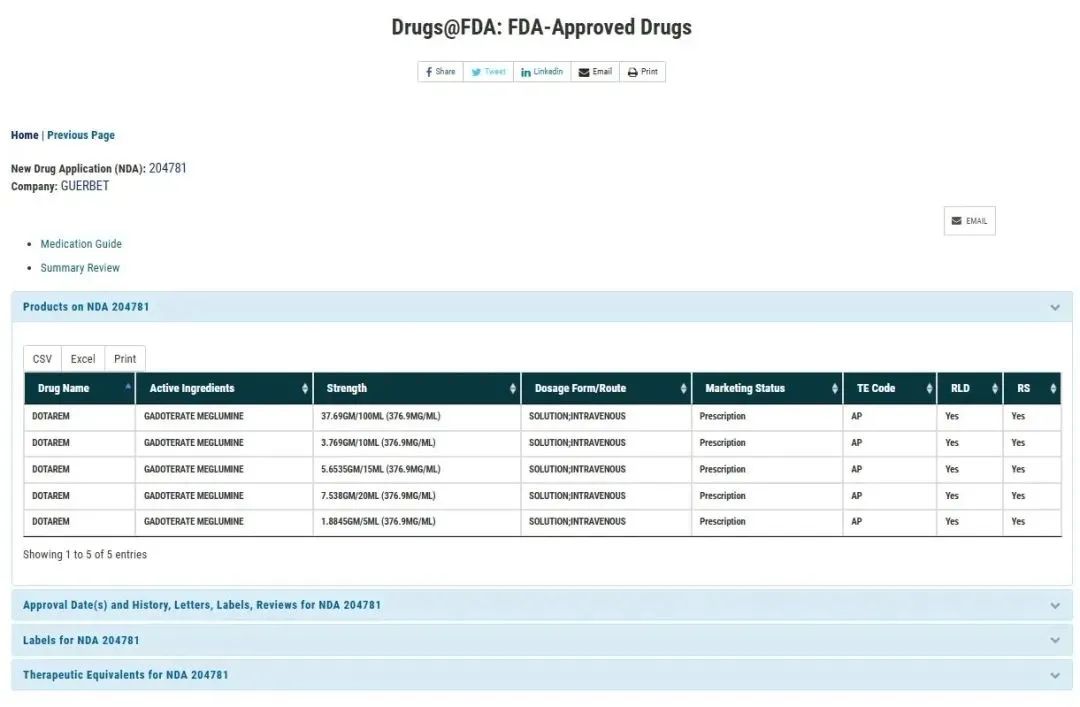
图片来源:美国FDA官网
普利制药钆特酸葡胺注射液完成技术研发后,逐步向国内外多个市场提交了产品的上市申请,已于2024年6月获得美国食品药品监督管理局的批准通知。

图片来源:美国FDA官网
钆特酸葡胺注射液国内与美国市场共用一条生产线,同质量标准,同产品品质,将为国内患者提供高品质的用药选择。
造影剂钆特酸葡胺注射液属于普利制药的原料制剂一体化品种,其原料来自海南普利制药股份有限公司子公司安徽普利药业有限公司。
2024年6月,安徽普利药业有限公司收到国家药品监督管理局签发的钆特酸葡胺化学原料药上市申请批准通知书(通知书编号:2024YS00506)。
国家药品监督管理局药品评审中心的原料登记数据
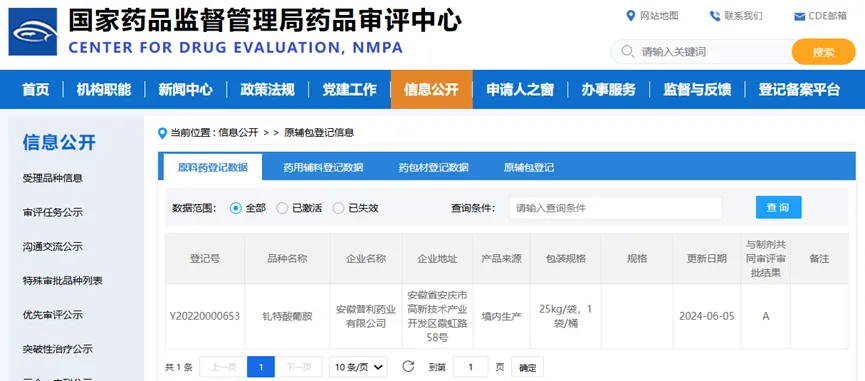
图片来源:国家药品监督管理局
作为原料制剂一体化品种,普利制药的钆特酸葡胺注射液不会受制于原料药市场,可稳定保障临床供应。
中美双报、共线生产且原料制剂一体化的普利影显®钆特酸葡胺注射液此次国内过评获批上市,将更好地满足国内患者高品质造影剂用药需求,具有较强的市场竞争力。
普利制药拥有包含钆特酸葡胺、钆特醇、钆布醇、碘帕醇、碘克沙醇、碘氟醇、碘海醇、乙碘油等多个的造影剂产品,并且均贯彻原料制剂一体化策略,品种相继上市美国、欧洲、中国市场。已经实现碘帕醇、钆特酸葡胺的中国获批,碘帕醇、钆特酸葡胺、钆布醇的美国获批和钆布醇的荷兰获批。
未来,普利制药将一如既往地实施“先进高端制造, 立足国内,面向国际”的战略,持续不断地开发更多更好的药物供应全球,为民族医药工业的壮大持续作出贡献。



合作咨询
![]() 肖女士
肖女士
![]() 021-33392297
021-33392297
![]() Kelly.Xiao@imsinoexpo.com
Kelly.Xiao@imsinoexpo.com
 2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57
2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57