自2019新型冠状病毒(2019-nCoV)肺炎疫情发生以来,针对2019-nCoV肺炎,各大科研院所及前线临床医生提出了很多可能有效的药物及治疗方法,部分治疗方法已申报临床或进入临床阶段。
目前,包括阿比多尔(Arbidol)(NCT04254874)、甲基强的松龙结合标准护理(NCT04244591)、连花清瘟胶囊/颗粒(ChiCTR2000029433)、洛匹那韦/利托那韦和干扰素α2b联合治疗(ChiCTR2000029308)、氯喹(ChiCTR2000029542)、瑞德西韦(Remdesivir)(NCT04252664、NCT04257656)及双黄连口服液(ChiCTR2000029605)等的临床试验均在开展中。但说到最受到人们关注、期待的药物,当属已经被很多人称为"新冠特效药"的瑞德西韦(Remdesivir)了。
2月5日下午,中日友好医院王辰、曹彬团队在武汉市金银潭医院宣布启动Remdesivir治疗2019新型冠状病毒感染的临床试验。中日友好医院方面介绍,上述临床试验将一共入组患者761例,其中轻、中症患者308例,重症患者453例。中日友好医院曹彬教授介绍,这项研究将执行严格的随机双盲试验,以评价瑞德西韦在新冠状病**肺炎的疗效和安全性。
本文将根据已登记在ClinicalTrials.gov上的两项关于Remdesivir治疗2019新型冠状病毒感染的临床试验的入组标准与排除标准,分析哪些患者可以参加瑞德西韦(Remdesivir)新冠肺炎临床试验?(注:受试者若参与某项临床试验,需同时满足该临床试验的所有入组标准,并不满足所有排除标准)。
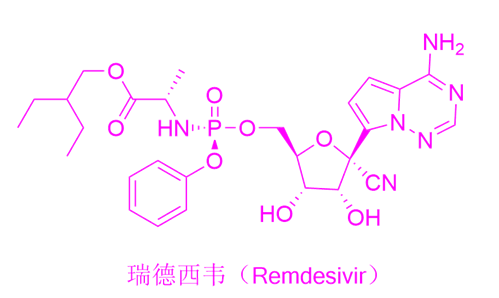
图1. 瑞德西韦(Remdesivir)结构
一. Mild/Moderate 2019-nCoV Remdesivir RCT(针对轻/中症2019新冠肺炎患者)
该试验(NCT04252664)主要针对轻/中症2019新冠肺炎患者,计划入组308例,受试者入组后将被随机分入试验组(接受Remdesivir治疗)或对照组(安慰剂),第一天给与Remdesivir或安慰剂负荷剂量200mg,然后连续9天给与Remdesivir或安慰剂维持剂量100mg IV QD。
图2. Mild/Moderate 2019-nCoV Remdesivir RCT(来源:ClinicalTrials.gov)
1、 入组标准:
(1)Age ≥18 years at time of signing Informed Consent Form
签署知情同意书时年龄需大于等于18岁
(2)Laboratory (RT-PCR) confirmed infection with 2019-nCoV
实验室(RT-PCR)确认2019-nCoV感染
(3)Lung involvement confirmed with chest imaging
胸部影像检查证实肺受累
(4)Hospitalised with:
※Fever - ≥36.7℃ -axilla or Oral temperature ≥ 38.0 ℃ or ≥38.6°C tympanic or rectal or
※And at least one of Respiratory rate >24/min Or Cough
因发热和呼吸频率或咳嗽原因住院:腋下温度≥36.7℃,或口腔温度≥38.0℃,或直肠温度或耳温≥38.6°C;且呼吸频率> 24次/分,或有咳嗽
(5)≤8 days since illness onset
发病时间小于等于8天
(6)Willingness of study participant to accept randomization to any assigned treatment arm.
愿意接受随机分配到任何治疗组
(7)Must agree not to enroll in another study of an investigational agent prior to completion of Day 28 of study.
必须同意在该研究完成的前28天不参加研究药物的另一项试验
2、 排除标准:
(1)Physician makes a decision that trial involvement is not in patients' best interest, or any condition that does not allow the protocol to be followed safely
医生认为参与该试验不符合患者的最佳利益或者存在不能安全遵循方案的任何情况
(2)Severe liver disease (e.g. Child Pugh score ≥ C, AST>5 times upper limit)
存在严重的肝 脏疾病(例如:Child Pugh评分≥ C级,谷草转氨酶AST超过正常值上限5倍)
(3)SaO2/SPO2≤94% in room air condition, or the Pa02/Fi02 ratio <300mgHg
室内空气条件下,患者的SaO2/SPO2≤94%;或Pa02/Fi02 <300mgHg
(4)Known allergic reaction to remdesivir
已知对瑞德西韦(Remdesivir)过敏
(5)Patients with known severe renal impairment (estimated glomerular filtration rate ≤30 mL/min/1.73 m2) or receiving continuous renal replacement therapy, hemodialysis, peritoneal dialysis
已知患者存在严重肾功能不全(估计egfr≤30mL/min/1.73m2),或正在接受连续性肾 脏替代治疗,血液透析,腹膜透析
(6)Pregnant or breastfeeding, or positive pregnancy test in a predose examination
患者怀孕,或处在哺乳期,或者用药前妊娠试验阳性
(7)Will be transferred to another hospital which is not the study site within 72 hours
患者将在72小时内被转移到不是研究中心的另一家医院
(8)Receipt of any experimental treatment for 2019-nCoV (off-label, compassionate use, or trial related) within the 30 days prior to the time of the screening evaluation
筛选评估前30天内接受过针对2019-nCoV的试验治疗(包括超说明书用药,同情用药或相关试验)
二. Severe 2019-nCoV Remdesivir RCT(针对重症2019新冠肺炎患者)
该试验(NCT04257656)主要针对重症2019新冠肺炎患者,计划入组452例(该例数为ClinicalTrials.gov所登记,比新闻报道453例少1例),受试者入组后将被随机分入试验组(接受Remdesivir治疗)或对照组(安慰剂),第一天给与Remdesivir或安慰剂负荷剂量200mg,然后连续9天给与Remdesivir或安慰剂维持剂量100mg IV QD。
图3. Severe 2019-nCoV Remdesivir RCT(来源:ClinicalTrials.gov)
1、入组标准:
(1)Age ≥18 years at time of signing Informed Consent Form
签署知情同意书时年龄需大于等于18岁
(2)Laboratory (RT-PCR) confirmed infection with 2019-nCoV
实验室(RT-PCR)确认2019-nCoV感染
(3)Lung involvement confirmed with chest imaging
胸部影像检查证实肺受累
(4)Hospitalized with a SaO2/SPO2≤94% on room air or Pa02/Fi02 ratio <300mgHg
因SaO2/SPO2≤94%(室内空气条件下)或Pa02/Fi02 <300mgHg住院
(5)≤12 days since illness onset
发病时间小于等于12天
(6)Willingness of study participant to accept randomization to any assigned treatment arm.
愿意接受随机分配到任何治疗组
(7)Must agree not to enroll in another study of an investigational agent prior to completion of Day 28 of study.
必须同意在该研究完成的前28天不参加研究药物的另一项试验
2、排除标准:
(1)Physician makes a decision that trial involvement is not in patients' best interest, or any condition that does not allow the protocol to be followed safely
医生认为参与该试验不符合患者的最佳利益或者存在不能安全遵循方案的任何情况
(2)Severe liver disease (e.g. Child Pugh score ≥ C, AST>5 times upper limit)
存在严重的肝 脏疾病(例如:Child Pugh评分≥ C级,谷草转氨酶AST超过正常值上限5倍)
(3)Pregnant or breastfeeding, or positive pregnancy test in a predose examination
患者怀孕,或处在哺乳期,或者用药前妊娠试验阳性
(4)Patients with known severe renal impairment (estimated glomerular filtration rate ≤30 mL/min/1.73 m2) or receiving continuous renal replacement therapy, hemodialysis, peritoneal dialysis
已知患者存在严重肾功能不全(估计egfr≤30mL/min/1.73m2),或正在接受连续性肾 脏替代治疗,血液透析,腹膜透析
(5)Will be transferred to another hospital which is not the study site within 72 hours.
患者将在72小时内被转移到不是研究中心的另一家医院
(6)Receipt of any experimental treatment for 2019-nCoV (off-label, compassionate use, or trial related) within the 30 days prior to the time of the screening evaluation.
筛选评估前30天内接受过针对2019-nCoV的试验治疗(包括超说明书用药,同情用药或相关试验)
三、总结
患者参加以上两项临床试验,需同时满足相应试验的所有入组标准,并不满足所有排除标准。由于这两项试验均为双盲试验,研究者与参与试验受试者均不了解其服用的药物是Remdesivir还是安慰剂,所以关于Remdesivir的新型冠状病**肺炎的疗效和安全性无法在第一时间被知晓。希望大家耐心等待试验最终结果,并衷心期盼该两项临床试验可以获得成功,成为名副其实的新冠"特效药",为广大患者带来新的希望,消灭肆虐的疫情。
(本文入排标准来源于ClinicalTrials.gov,并由英文内容翻译而来,中文内容可能由于个人理解不同存在部分偏差,若有疑问请在评论区指正。本文仅仅是对相关试验入排标准的翻译解读,若有临床疾病相关疑问,请咨询相关临床医生。)
点击下图进行CPhI & P-MEC China 2020观众预登记,立省100元观展门票!



合作咨询
![]() 肖女士
肖女士
![]() 021-33392297
021-33392297
![]() Kelly.Xiao@imsinoexpo.com
Kelly.Xiao@imsinoexpo.com
 2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57
2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57