木犀草素具有丰富的生物活性和广泛的药理活性,可调节众多与疾病进展有关的细胞内外信号通路,其化学结构如下图所示。然而,低溶解度和较低的生物利用度限制了木犀草素的应用。因此,研究者试图通过各种方法设计和合成许多新的木犀草素衍生物,通过优化修饰以获得溶解性能好、生物利用度高、活性明显改善、抗癌活性增强的木犀草素衍生物。
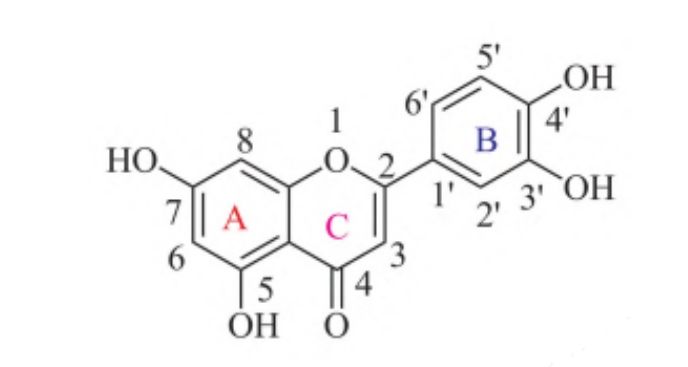
木犀草素的化学结构
木犀草素具有C6-C3-C6 碳骨架的苯并-γ-吡喃酮结构,A环中C5和C7处存在羟基,属于间二酚结构,B环含有邻二酚羟基(3,4-二羟基),C环C4位是个羰基,C2-C3含有双键,即C环含有α、β-不饱和酮结构。4个酚羟基和α、β-不饱和酮结构决定了木犀草素的性质,具有强抗氧化性。木犀草素的三个环是扭曲的平面,在该体系中,分子内可形成两个氢键,一个氢键是由C5-OH和C4=O羰基建立,另一个在B环的邻位羟基之间形成。木犀草素因其显著的抗氧化和抗癌活性而被广泛研究,修饰不同基团,得到的衍生物具有不同的生物活性和功效。
研究比较发现,含脂肪链的5-O酰基衍生物具有更好的抗肿瘤活性,同时保持了与木犀草素相似的自由基清除活性,含苯基的衍生物显著降低了其抗增殖活性和清除自由基的活性。7-O磷酰胺衍生物对人肝癌细胞抗增殖活性较好;5-O酰基和7-O酰基衍生物具有比木犀草素更强的多巴胺转运体(DAT)激动剂活性,作为治疗精神疾病的药物潜力巨大。木犀草素的羟基与磷酸生成的酯水溶性增强。木犀草素的C7-OH与卤代烃反应生成的醚具有抑制黑色素瘤作用。木犀草素的8-位氨甲基化产物具有很好的抗菌活性。木犀草素的C4=O的氧被硫取代具有很好的抗乳腺癌的活性。木犀草素的C8上的氢被甲氨基取代抗流感和抗炎效果一般,抗癌效果显著。木犀草素的配合物具有抗菌、降糖等作用。
1、羟基的修饰
①酯化反应
研究结果显示,与木犀草素相比,含脂肪链的5-O 酰基衍生物具有更好的抗肿瘤细胞增殖活性,且具有与木犀草素相似的自由基清除活性,表明该类衍生物的抗增殖活性与清除自由基活性无关。含苯基的木犀草素衍生物可显著降低其抗增殖活性和清除自由基的活性。磷酰胺酸酯是一类新的抗癌药物,效力因磷酰胺部分的基团(芳基、酯和氨基酸)而异。木犀草素与乙酸酐反应,在硫酚作用下脱去木犀草素-7-位的乙酰基,加入L-氨基酰氯、二氯磷酸苯酯反应,用吡咯烷脱去乙酰基可得到木犀草素-7-磷酰胺衍生物,并对人肝癌细胞系 HepG2抗增殖活性进行测试。结果显示,其可诱导HepG2细胞发生G2/M期阻滞,显示出诱导HepG2细胞早期凋亡的作用。此外,木犀草素磷酸酯类衍生物能有效解决木犀草素在水中难溶解、生物利用度低的问题。
②成醚反应
木犀草素在硼砂(四硼酸钠)作用下与卤代烷反应,能合成木犀草素-7-O-衍生物,实验显示,该类衍生物显示出改善黑色素合成和黑色素细胞增殖抑制活性。木犀草素对许多细菌具有抗菌活性,但关于木犀草素衍生物的抗菌活性的研究报道甚少。有学者合成了 3′4′-亚乙基-7-乙基(N,N-二乙基)胺槲皮素等一系列木犀草素衍生物,并评价了其对枯草杆菌、金黄色葡萄球菌、荧光假单胞菌和大肠杆菌的抑菌活性。生物活性测定表明,部分化合物具有较高的体外抑菌活性。木犀草素衍生物的构效关系研究表明,木犀草素衍生物的亲水性和芳香性可能是影响其抗菌活性的重要因素。木犀草素、芹菜素和白杨素等黄酮类化合物具有抑制α-葡萄糖苷酶活性的能力。将木犀草素和 K2CO3加入二甲基亚砜中,滴加 1,2-二溴 乙烷,在70 ℃加热1 h。加入溴代烷反应,可分离可得到烷基化木犀草素衍生物。实验显示,所有衍生物的糖苷酶抑制活性均显著高于参比药物。
2、羰基氧被取代的反应
木犀草素与硫酸二甲酯反应可得到四甲基木犀草素,其后加入劳森试剂反应,可得到4-硫代四甲基木犀草素。4-硫代四甲基木犀草素加入BBr3,可反应得到4-硫代木犀草素。实验显示,4-硫代四甲基木犀草素和4-硫代木犀草素在体外划痕实验中均显示出显著的抗血管生成活性。木犀草素衍生物对人乳腺癌 MCF-7 细胞的细胞毒性评估也显示出直接的抗癌活性,表明木犀草素衍生物作为抗血管生成活性显著。木犀草素中有1个羰基,可以与胺反应生成席夫碱。但是实验发现木犀草素与伯胺不反应,可能是由于木犀草素的环与环共振具有芳香性,4个羟基的给电子效应,使得羰基的活性降低,不能很好的与伯胺反应生成席夫碱。根据氯原子具有吸电子效应,相对于酚羟基能够降低苯环上电子云密度,提高羰基的亲电反应活性,通过将木犀草素的3个羟基被氯取代,使其羰基具有足够高的活性与伯胺直接合成制备席夫碱。试验表明,合成得到的7,3′,4′-三氯木犀草素席夫碱衍生物可以减轻小鼠耳肿胀程度和足肿胀程度,对急性炎症具有明显的抑制作用。
3、C-8的氢被取代的反应
木犀草素的A环5-羟基与4-羰基和B环上的羟基与金属离子的强相互作用使得木犀草素具有很高的亲和力和抑制性。因此,对木犀草素的结构进行修饰,可以提高抑制效力和药动学性质。已有研究表明木犀草素可显著抑制聚合酶酸性蛋白(polymerase acidic protein,PA),是有效的抑制剂。木犀草素与甲醛和仲胺反应,可以得到 C-8 木犀草素甲基胺衍生物。实验显示,C-8 木犀草素甲基胺衍生物是最有效的抑制剂,其抑制效力优于木犀草素。室温下木犀草素与甲醛、胺反应能得到Mannich 碱衍生物,体外抗癌活性实验表明部分化合物显示出比木犀草素、5-氟尿嘧啶更好的抗癌活性。以木犀草素为先导化合物,利用A环C-8 位 H 的活性与脂肪伯、仲胺在甲醛或乙醛水溶液中进行 Mannich 反应,反应条件温和,合成可得到新的8-氨甲基化衍生物。采用二甲苯诱发小鼠耳廓炎症模型对抗炎活性进行了初步筛选,试验结果表明,所测试的目标化合物均具有一定程度的抗炎活性。
4、配位反应
大多数黄酮类化合物是有效的金属螯合剂,具有很强的抗氧化和清除自由基的活性,如芦丁、槲皮素和木犀草素已被证明是良好的螯合配体。木犀草素锰配合物具有更高的生物活性,包括抗氧化、抗菌和降血糖活性。结果表明,木犀草素和木犀草素锰配合物能以竞争性方式可逆地抑制黄嘌呤氧化酶,木犀草素锰配合物显示出比木犀草素更强的抑制黄嘌呤氧化酶的活性。木犀草素锰配合物比木犀草素具有更显著的降血糖作用,能增加肝组织中葡萄糖的消耗。此外,研究表明,木犀草素钒配合物对MDAMB2311细胞的活性抑制作用高于配体,对人肺癌A549 细胞的抑制作用比木犀草素稍高。以木犀草素和磺胺甲恶唑进行缩合再与铜或锌离子络合可形成木犀草素磺胺配合物,进行初步的抗菌活性实验。结果显示,木犀草素磺胺配合物对多种菌株有明显的抑菌活性且优于各自的母体。此外,研究结果表明木犀草素磺酸配合物对 DPPH 的清除率和对金黄色葡萄球菌和大肠杆菌的抑制作用随浓度的增大而提高,且效果也优于木犀草素。
5、聚合反应
以木犀草素为原料,采用温和的一锅煮聚合法可制备木犀草素水分散纳米球,与木犀草素在高剂量下具有细胞毒性不同,聚木犀草素纳米粒具有剂量相关的抗炎活性,在高剂量下没有细胞毒性。表明水分散的聚木犀草素纳米粒有望发展成为一种用于治疗的抗炎剂。
木犀草素是一种有价值的天然黄酮类化合物,由于能够调节多种靶点和信号通路而得到了广泛研究。木犀草素的低溶解性和生物利用度限制了其应用。因此,设计和合成新的木犀草素衍生物来改变其局限性势在必行。目前,对木犀草素的结构进行优化修饰,已经合成了许多溶解性能好、生物利用度高的木犀草素衍生物,在抗癌、抗氧化、抗菌、抗炎、降糖等方面有许多优势,应用前景广阔。
参考资料
[1]姜亚玲,李文渊,冯爽,等.木犀草素的结构修饰及其生物活性研究进展[J].中草药,2023,54(20):6889-6902.
[2]冯爽,姜亚玲,刘金海,等.木犀草素衍生物研究进展[J].化学通报,2024,87(03):300-309.
作者简介:小泥沙,食品科技工作者,食品科学硕士,现就职于国内某大型药物研发公司,从事营养食品的开发与研究。



合作咨询
![]() 肖女士
肖女士
![]() 021-33392297
021-33392297
![]() Kelly.Xiao@imsinoexpo.com
Kelly.Xiao@imsinoexpo.com
 2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57
2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57