2024年10月9日,蛋白质设计先驱 David Baker 教授与AlphaFold开发者 Demis Hassabis、John Jumpe 共同获得了2024年诺贝尔化学奖,表彰他们在"计算蛋白质设计"领域和"蛋白质结构预测"方面的突破。

2024年9月25日,David Baker课题组和Carolyn Bertozzi教授团队在nature期刊上发表了题为"Designed endocytosis-inducing proteins degrade targets and amplify signals"的文章,该研究提出了一种新型的靶向蛋白降解模式--蛋白LYTAC(pLYTAC),这项技术结合AI,在靶点特征基础上从头设计与之结合的全新蛋白质,为多种难治疾病的精确治疗开辟了新的可能性。
1、靶向蛋白降解的挑战
靶向蛋白质降解是一种前景广阔的策略,用于治疗由有害蛋白质引发的疾病。此方法通过内源性配体触发细胞表面受体的内吞作用和溶酶体转运,采用如溶酶体靶向嵌合蛋白(LYTACs)和细胞因子受体靶向嵌合蛋白(KineTACs)等手段,通过与修饰的天然配体融合,精确靶向特定蛋白的降解(图1)。然而,这些方法面临一些挑战,首先,与天然配体的竞争可能降低靶向效率;其次,对化学修饰的依赖限制了其遗传可编码性,使得大规模应用受限;此外,缺乏能够有效诱导内吞作用的天然配体进一步缩小了适用范围。这些因素共同影响了靶向蛋白降解技术的广泛应用和临床转化。针对这些挑战,David Baker课题组和Carolyn Bertozzi教授团队提出了一种新型的靶向蛋白降解模式--蛋白LYTAC(pLYTAC),这项技术可以从活细胞中消除各种疾病相关的分子靶点,为多种难治疾病的精确治疗开辟了新的可能性。
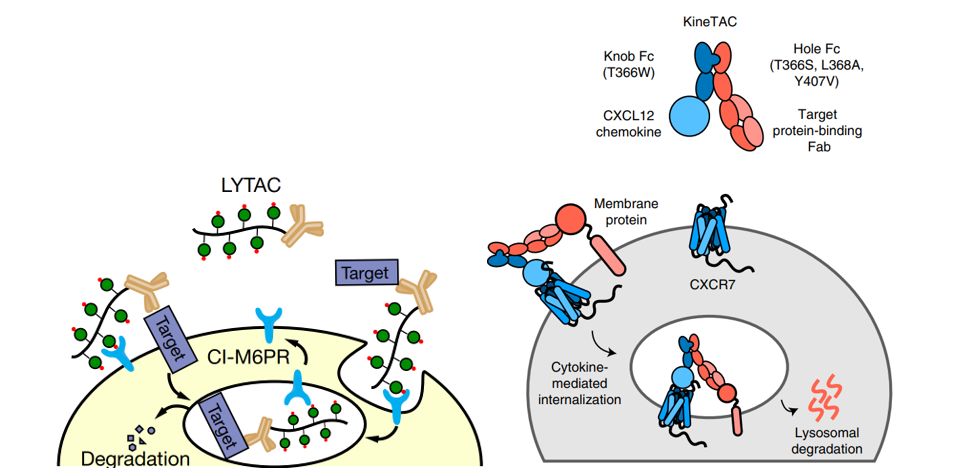 图1.LYTAC和KineTAC作用机制示意图
图1.LYTAC和KineTAC作用机制示意图
2、引入EndoTags
研究人员利用先进的计算方法开发了一种名为胞吞触发结合蛋白(EndoTags)的合成蛋白,它能够特异性结合参与内吞作用的细胞表面受体,从而促进内吞过程。这些EndoTags的设计无需复杂的化学修饰,且可通过基因编码实现。通过将EndoTags附加到识别并结合疾病相关靶标的其他蛋白上,研究人员创建了基于蛋白质的溶酶体靶向嵌合体(pLYTAC),能够有效将不需要的蛋白质导向溶酶体进行降解。例如,在针对表皮生长因子受体(EGFR)的研究中,pLYTAC与EGFR结合域的结合显著降低了EGFR水平,效果优于现有方法。此外,在针对程序性死亡配体1(PD-L1)的研究中,在小鼠肿瘤模型中,与单独抗体相比,与PD-L1抗体融合的EndoTag显著提高了疗效(图2)。作为基因编码蛋白技术,EndoTags和pLYTACs可通过治疗性mRNA或基因治疗方式传递,并因其设计与特定受体结合而不干扰天然配体,从而降低脱靶效应的风险。
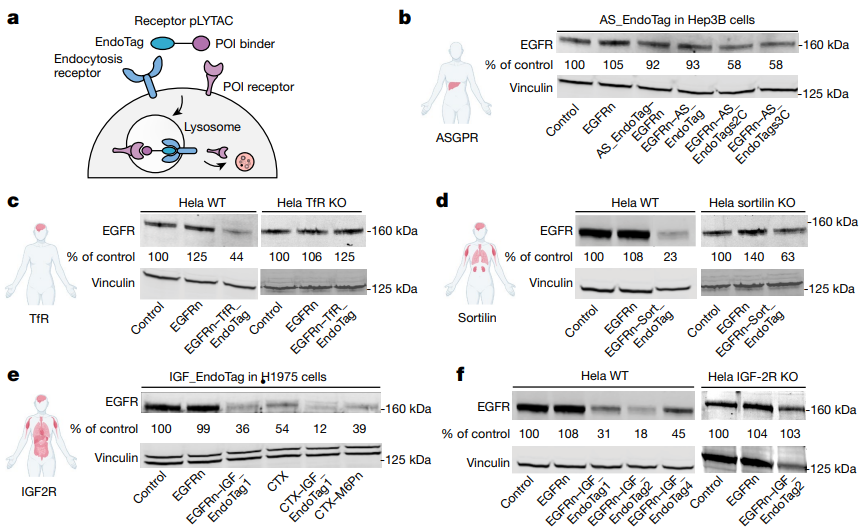
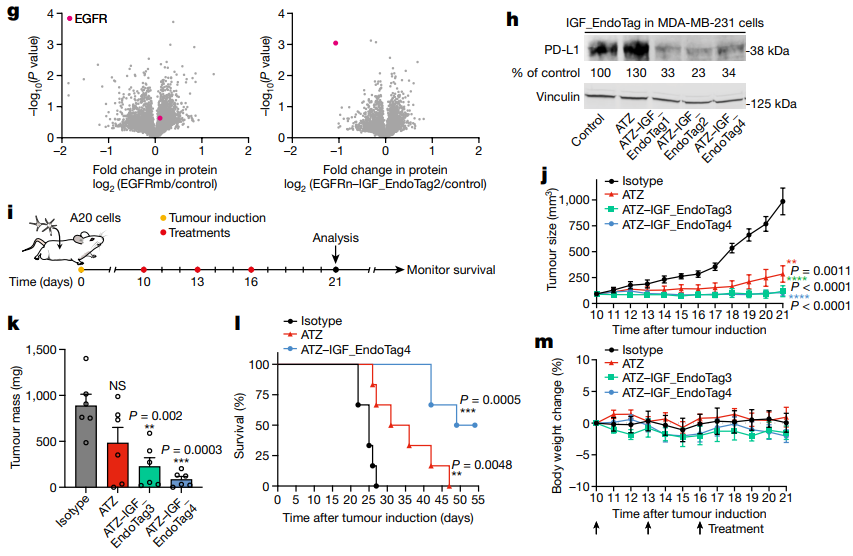
图2.组织特异性pLYTAC的表面受体降解
3、技术突破与设计策略
研究人员为不同机制和组织分布的受体定制设计EndoTags。针对组成循环受体(如Sortilin和Transferrin受体),研究人员设计了与其非重叠位点结合的内标签,以避免与天然配体竞争,从而劫持内吞途径,实现目标蛋白的内化和降解。在设计过程中,他们利用Rosetta 从头预测蛋白结构,定位Sortilin和Transferrin受体上远离天然配体结合位点的表位,生成数千种候选结合物,并通过实验筛选其亲和力和特异性。对于需要构象变化的受体(如胰岛素样生长因子2受体,IGF-2R),研究人员设计了能够与其两个不同结构域结合的EndoTags,以诱导必要的结构重排并触发内化。这一过程涉及开发粘合剂并将其融合为一个单一分子,以桥接两个结构域,需精确建模空间方向与结合域之间的灵活性。最后,对于聚类触发的受体(如非唾液酸糖蛋白受体,ASGPR),研究人员通过连接多个结合域创建了多价EndoTags,以促进结合后的受体聚集,此设计通过组装成二聚体或三聚体的形式增强了结合能力,有效诱导受体的聚集与内化(图3)。
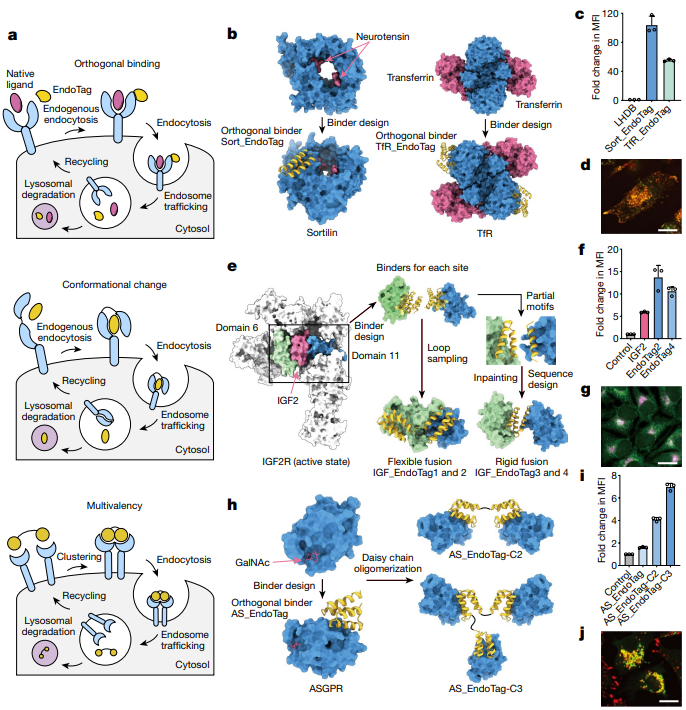 图3.内吞触发EndoTags的设计策略
图3.内吞触发EndoTags的设计策略
4、逻辑门控系统的精确瞄准
在这项研究中,研究人员创新性地将多个EndoTags与之前报道的逻辑门控开关技术相结合,构建了一种仅在特定条件下诱导降解的逻辑门控pLYTAC。这一设计使得pLYTAC能够在HER2在同一细胞表面表达时,专门诱导EGFR的降解,从而显著增强了靶向蛋白降解的细胞精确定位(图4)。EndoTags的模块化特性及其遗传可编码性,使得逻辑门控pLYTAC能够实现更高的特异性靶向降解,同时促进从工程细胞中局部分泌降解物的过程。此外,通过促进内吞作用,EndoTag的融合利用工程配体受体系统显著提高了近100倍的信号传导能力。这一机制不仅使EndoTags在靶向降解诱导中展现出强大的能力,还使其成为内吞依赖途径的信号激活剂。此外,EndoTags还能够作为靶向抗体药物和抗体RNA偶联物的细胞摄取诱导剂,展现出相当大的治疗潜力。这种策略为靶向蛋白降解和相关治疗提供了新的思路,可能为未来的精准医疗带来重要的应用前景。
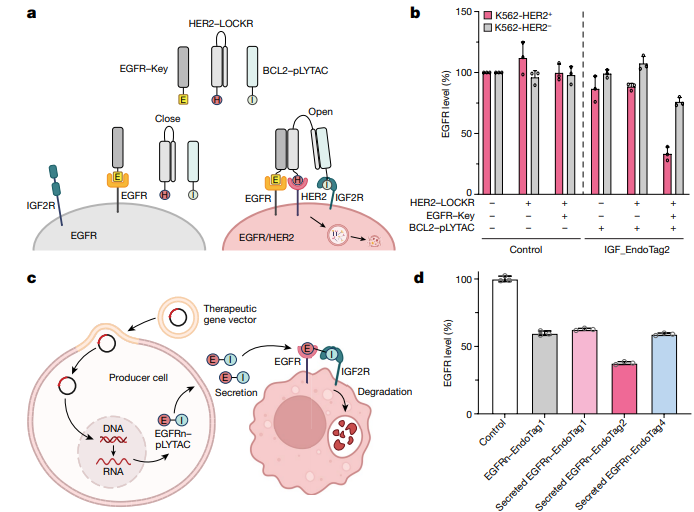 图4.逻辑门控靶向降解和局部分泌降解
图4.逻辑门控靶向降解和局部分泌降解
5、结论与展望
在这项研究中,研究人员展示了利用人工智能和机器学习技术,在靶点特征基础上从头设计与之结合的全新蛋白质的显著进展。针对与细胞内吞相关的受体结合的EndoTags,研究人员设定了多个关键要求,以确保其有效性。首先,这些EndoTags与受体的结合必须不会干扰受体与其天然配体之间的相互作用。此外,有些EndoTags还需要能够诱导受体的构象变化或促进受体的聚集,从而增强内吞作用的发生。这一目标要求对受体蛋白上的特定表位进行精准设计,以确保结合的特异性和有效性。研究人员指出,基于人工智能的蛋白设计策略已显著提高了成功率,达到原有水平的10倍以上。这一进展使得这种策略能够成为实验室常规操作的一部分,从而加速了相关研究的进展。通过这种方法,研究人员能够更加高效地开发出具有潜在治疗价值的结合蛋白,进一步推动靶向蛋白降解及相关疗法的发展。总之,这项工作代表了靶向蛋白质降解领域向前迈出的重要一步。创造一种通用的、基因可编码的蛋白质消除技术,为针对目前被认为难以治疗的各种疾病的精确治疗开辟了新的可能性。后续,研究人员将进一步扩大EndoTags的靶标范围,潜在地为更多疾病提供治疗。同时,他们也计划探索pLYTACs的临床应用,希望开发治疗癌症、自身免疫性疾病和神经系统疾病的新疗法。
参考文献
[1]Banik SM, Pedram K, Wisnovsky S, Ahn G, Riley NM, Bertozzi CR. Lysosome-targeting chimaeras for degradation of extracellular proteins. Nature. 2020 Aug;584(7820):291-297. doi: 10.1038/s41586-020-2545-9.
[2]Pance K, Gramespacher JA, Byrnes JR, Salangsang F, Serrano JC, Cotton AD, Steri V, Wells JA. Modular cytokine receptor-targeting chimeras for targeted degradation of cell surface and extracellular proteins. Nat Biotechnol. 2023 Feb;41(2):273-281. doi: 10.1038/s41587-022-01456-2.
[3]Huang B, et al. Designed endocytosis-inducing proteins degrade targets and amplify signals. Nature. 2024 Sep 25. doi: 10.1038/s41586-024-07948-2.
[4]https://www.bakerlab.org/2024/09/27/targeted-protein-degradation-through-advanced-protein-design/.



合作咨询
![]() 肖女士
肖女士
![]() 021-33392297
021-33392297
![]() Kelly.Xiao@imsinoexpo.com
Kelly.Xiao@imsinoexpo.com
 2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57
2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57