质量源于设计 风险源于认知
任何一个国家或地区的药典标准建立,本身可以定义为一个"标准的设计",而我国制药行业依据此"设计"将做出对应的安全措施与节能减排措施,制药行业可以从认识药典标准并更新它这个角度去分析、总结。理论上来讲,一个设计合理的药典标准,实际上也是能实现"为企业增效,为社会造福"的。当我们对制药行业纯化水药典标准横向对比做地越多,研究地越透彻的时候,越觉得我国药典的发展空间还很大。
首先,当谈及制药行业与制药用水,则必须承认制药用水的质量标准为饮用水,如果符合GB饮用水,则代表它是一种制药用水,如果不能满足,则必须在制水间进行净化处理,至少达到饮用水标准后才能输送到使用点。
无论是自来水,井水,河水,湖水,还是山泉水,在制药行业作为源水时只有一个原则:这个源水如果符合或超过饮用水,则是标准的制药用水,如果不是,则需要预处理。因为中国制药企业无法从市政管网系统得到安全、稳定的饮用水作为源水,因此,才会出现与欧美发达国家在制定药典标准、实施GMP方面的差异。
由于我们国家市政行业的自来水公司普遍无法实现将符合GB的饮用水输送到制药企业厂区内,自来水企业仅仅能确保的是自来水厂出水口水质符合饮用水,而输送管网没有管控,因此,预处理的责任与负担转移到了制药行业,从而带来了一系列的行业问题,例如:1)企业因没有饮用水,在历史经验中,拔高设计标准,普遍采用纯化水洗手或洗衣,2)药典指标参数很多,把饮用水需要关注的责任放到了纯化水药典标准,例如硝酸盐、重金属等;3)因为没有饮用水,为了安全起见,药典部门将欧洲纯化水药典产品水指标也放到了中国纯化水药典的原料水指标等;4)因为没有饮用水,中国注射用水药典指标中将蒸馏法的原水强制规定为纯化水,而美国只需要饮用水,等等。
首先,谈一下纯化水制备方法,一个概念:纯化水机的作用,源水(饮用水)+合适的净化工艺=药典纯化水,客观来讲,饮用水+RO/EDI就能制备纯化水,所以,国外纯化水机专指RO/RO或RO/EDI这类装置(前提是饮用水及以上的水源),国内因为没有饮用水,所以,我国制药行业通常将纯化水机默认为"预处理设施+纯化设施"两部分。基于这个原因,类似EDI模块设计在在中国与欧美也不尽相同,例如,在美国,因为有些企业直接用饮用水作为原水,没有预处理设施,EDI模块的浓水口与极水口是分开设计的,浓水口一般可以直接回到RO之前,极水口则建议直接排放或回到其他可以去除余氯的前端工艺测;而在中国,因为EDI浓水与极水都可以直接回到预处理的原水罐,因此,某些厂家的EDI模块设计采用浓水口与极水口合并后直接回到原水罐也是符合要求的。
(1)蒸馏法 纯化水制备中,有一个方法叫蒸馏法,实际上在制药行业制备纯化水环节被忽视了,这主要是因为我国产水温度为常温的热压式蒸馏水机没有得到普遍推广,而多效蒸馏水机因为出水温度高,不合适,实际上,饮用水+热压蒸馏水机完全可以制备符合药典的纯化水。
补充一个小知识:客观来讲,饮用水+多效蒸馏水机可以制备符合药典的注射用水(大家可以看美国药典WFI制备法),因为WFI重点是去除内毒素技术,饮用水的内毒素指标范围大致不会超过50-100EU/ml,常规蒸馏法(热压、国内外常规多效)的内毒素去除能力为2-3个log,因此,采用饮用水+蒸馏法制备内毒素含量小于0.1EU/ml注射用水不存在任何技术问题,国内采用纯化水+蒸馏(热压或多效)则更没有问题了,因为纯化水内毒素指标(通常为1-10 EU/ml)比饮用水好得多。
为什么类似部分企业的多效蒸馏水机能承诺内毒素低于0.01EU/ml?因为它有内螺旋分离技术,对内毒素去除能从2-3log提高到4log,所以,理论上,饮用水+内螺旋技术的多效蒸馏水机可以制备出内毒素低于0.01EU/ml注射用水。而在我国药典,注射用水制备的源水必须为纯化水,则经常会有供应商声称内毒素可以控制在0.003EU/ml以下,一点也不夸张。
刚才谈了很多蒸馏法,其实,热压蒸馏水机是能够制备纯化水的,热压蒸馏水机最开始的研发单位为美国军方,主要就是用于将不干净的湖水等水源变成可饮用的饮用水,同理,它也有能力将饮用水变成符合药典的常温出水的纯化水。
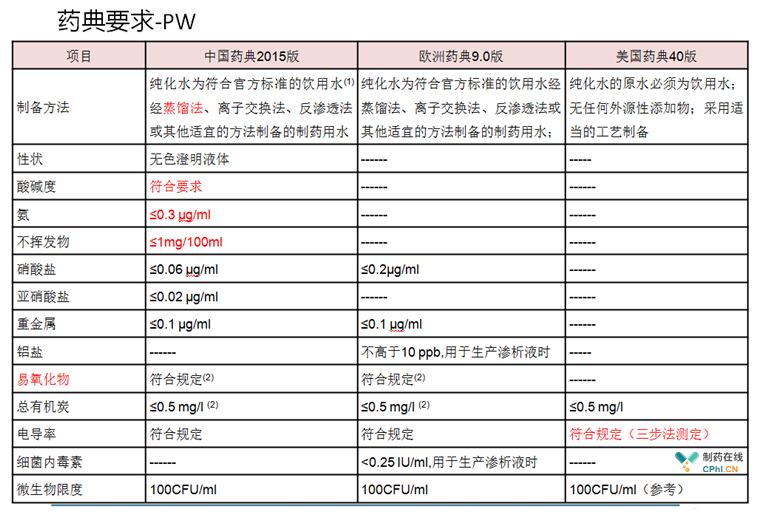
(2)性状、酸碱度、不挥发物、氨 虽然每个国家的药典都有其特殊性,中国药典纯化水指标如何发展,我们还是需要遵从我国国情及药典部门的综合评估而定。不过,今天讨论的仅为结合欧洲药典及美国药典的发展变化来做一个解释,对我国药典委员会提供一个参考,大家可以明显看到,性状、酸碱度、不挥发物、氨四个指标在欧美常规制药企业检测是没有的,因为欧洲药典的纯化水分为"water in bulk"和"water in container"两种形式,也就是俗称的散装水/原料水与包装水/产品水。性状、酸碱度、不挥发物、氨这四个指标在欧洲药典有明确的测定范围,只在water in container中测定,为什么有water in container这个药典水类型,因为在欧洲,允许一些特殊使用工况从其他企业买"产品水"来进行制药生产,这在我国还暂时没有开放。

(3)硝酸盐与亚硝酸盐 大家看下面的对比表,很明显,中国药典把这两个指标规定的很严格,这可能与我国国情有关,很多企业把自来水当制药用水(饮用水)使用,从而,为了更加严格的进行监管,我国制药行业将硝酸盐与亚硝酸盐进行了更加严格的指标规定。可以肯定的是,欧洲药典硝酸盐只要求0.2ug/ml,制定这个指标的出发点应该是基于源水为饮用水。
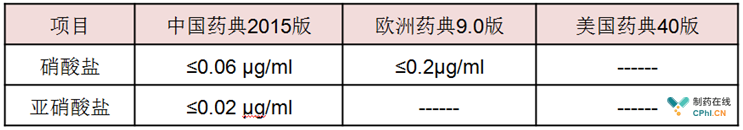
需要关注的是,美国药典在1996年就采用鼓励在线监测技术替代微量元素检测法,欧洲药典已经明确在2018年4月1日取消纯化水硝酸盐含量与外观的检测要求。经常有中国的制药企业说亚硝酸盐(甚至硝酸盐)指标超标,这个一方面说明我们的指标定的严,容易导致检测指标超标;另一方面可能的原因是纯化水机本身的去硝酸盐/去亚硝酸盐持续能力不够,可能与预处理机设计也有关系。
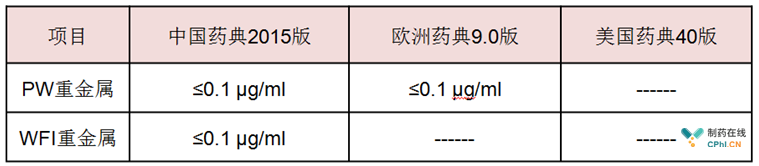
(4)重金属 可以看到,中国药典与欧盟药典的纯化水指标有重金属含量规定,中国药典的注射用水指标有重金属含量规定,欧美对于WFI重金属不做规定,这主要是基于低电导率的制药用水无法检测出重金属含量。
(5)易氧化物与TOC中/欧与美国药典的区别,主要是基于纯化水电导率的不同,所以,中/欧药典都规定二选一。因为三个国家/区域的药典标准电导率在WFI指标上是一样的,所以,中国与欧盟药典都不允许易氧化物法用于WFI测定,未来,等到中国欧盟的纯化水指标也与美国药典标准一致以后,易氧化物指标可能也会被彻底淘汰掉。
(6)微生物限度 看上去每个国家药典都是100CFU/ml(PW)与10CFU/100ml(WFI),实际上,仔细研究了美国药典发现,微生物限度在美国药典中为一个观察项,具体这个指标大家可以多阅读一下《FDA高纯水检查指南》,这里面对微生物限度的描述比较清晰,分析的也非常透彻,总的来说,就是美国药典规定:不能只看微生物数值,还需观察微生物的种类。一个新的技术LIF(在线微生物限度的测定),已经从工业技术上面世了,它与TOC一样,属于更加准确的定量分析方法,以美国为首的制药行业目前都在鼓励运用这个PAT技术,说明它很可能会代表未来的方向,仅仅是时间问题,这个指标的具体技术大家可以看看《制药用水系统(第二版)》的自控章节,相信我们国家的药典与药监部门都会大力鼓励在线检测技术的运用。
(7)电导率限度 电导率限度是未来中国药典发展的主要风向标。
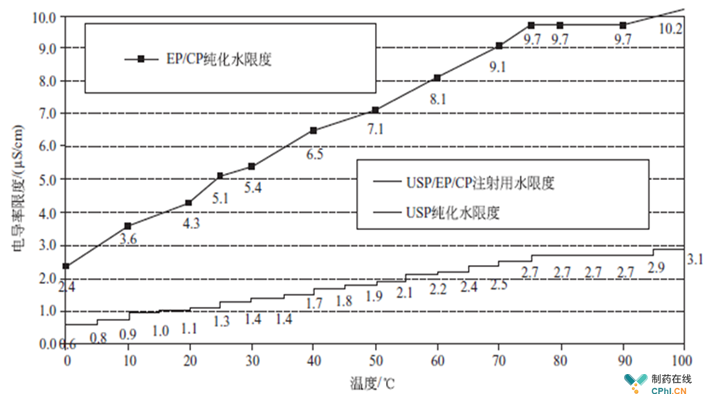
这张图,基本上代表了现行中国/欧盟药典纯化水与美国纯化水在电导率方面的核心区别,简单点说:中国欧盟药典电导率5.1us/cm@25度,美国药典1.3us/cm@25度,从而带来了一系列的区别,例如纯化水硝酸盐(中国欧洲药典有,美国药典没有),纯化水重金属(中国欧洲药典有,美国药典没有),易氧化物法(中国欧洲药典允许,美国药典不允许)。
无论中国、欧盟还是美国,WFI的药典标准对于电导率都是三步法。纯化水中国药典与欧盟药典因为限度为5.1us/cm@25度,很宽松,所以,中国与欧盟的纯化水电导率检测方法为"一步法",也就是说离线或在线取样指标连5.1us/cm@25度都达不到,肯定水质有问题。美国药典纯化水电导率是1.3us/cm@25度,它遵循的是三步法测电导,具体可参考中国药典2015版附录或者《制药用水系统(第二版)》第一章,里面有清晰的三步法测定电导的方法。
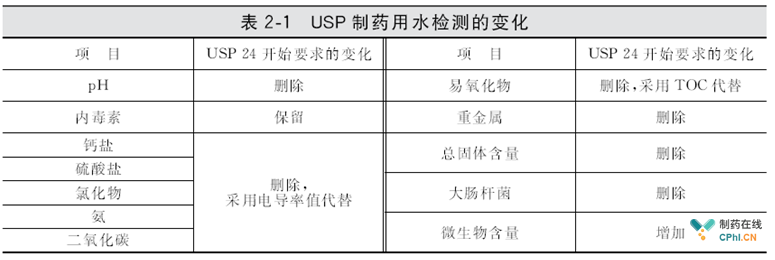
这里,尤其注意的是,21年前的1996.11.15,美国USP24做了一个革命性变化,直接采用"电导、TOC、微生物与内毒素"四个指标,取代了很多零散的检测指标,这个变化是制药用水药典指标革命性的区别。
有一个地方需要大家关注,经常有行业内同事反馈车间的纯化水系统按照中国和美国两个标准设计的,纯化水离线电导偶尔超过了1.3us/cm@25度,很焦虑,担心水质不合格,其实,这是2个不同的质量体系判定标准,如果按照中国药典去实施,则一步法(5.1us/cm@25度),如果还需要符合FDA GMP,则三步法(1.3us/cm@25度),不要用一步法去做美国药典的检测,因为纯化水为常温状态,离线取样后会与少量二氧化碳融入,电导率升高比较显著;而注射用水因为是高温状态,离线取样后很难融入二氧化碳,电导率变化不大。需要关注的是,欧洲药典已经明确在2018年4月1日开始,纯化水电导率采用注射用水标准,也就是美国药典的三步法,这将是一个非常大的参数变革。
结合制药用水欧美药典及行业发展的轨迹,我国药典的发展与变革将在接下来的10年左右会有较大的变化,纯化水药典究竟如何变化与发展,我们拭目以待。
参考文献
1. 国家药品食品监督管理局,药品生产质量管理规范(2010年修订),2010
2. 国家药典委员会,中华人民共和国药典2015年版,中国医药科技出版社,2015
3. European Pharmacopoeia 9th,2016
4. U.S. Pharmacopeia National Formulary 41,2017
5. The American Society of Mechanical Engineers,ASME BPE 2014,2014
6. ISPE,Volume 4:Water and Steam Systems (Second Edition),2011
7. WHO Expert Committee on Specifications for Pharmaceutical Preparations fourty-sixth Report,Annex 2:WHO Good Manufacturing Practices:Water for Pharmaceutical Use,2012
8. FDA,Guide to Inspections of High Purity Water Systems,1993
9. 国家食品药品监督管理局药品认证管理中心,中国医药科技出版社,GMP实施指南,2010
10. 张功臣,化学工业出版社,制药用水系统,2016
【专家简介】张功臣,制药行业专家,主要从事制药流体与生物工艺系统的研究与实践,全国制药工程设计竞赛委员会专家,ISPE培训专家,国家药监局检查员培训专家,国家标准《GB50913-2013 医药工艺用水系统设计规范》编委。



合作咨询
![]() 肖女士
肖女士
![]() 021-33392297
021-33392297
![]() Kelly.Xiao@imsinoexpo.com
Kelly.Xiao@imsinoexpo.com
 2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57
2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57