文/咨询专家:张功臣/国家药典委制药用水课题组专家
2020版《中国药典》已经面世,该药典虽收载了0261制药用水通则,但在制水工艺、过程控制、可操作性以及生产设施等方面都还有很大的提升空间,近几年国际药典的更新和技术的进步非常快。制药用水涉及药品生产的各个环节,是保证药品安全的重要因素,为满足当前中国制药行业发展的需求,完善制药用水工艺以及过程控制,修订完善制药用水通则也是行业发展的需要。
我国实施《药品生产质量管理规范》(2010年修订)已十余年时间,参考当前国际药典和相关国际组织对制药用水的技术要求,结合以基于风险的原则和我国制药用水以及设备的整体状况,进一步完善当前药典收载的0261制药用水通则,加强制药用水的源头和过程控制要求,推进先进、节能、环保的工艺设施的应用,提高制药用水的质量对进一步保障药品的安全性意义重大。
第1节 制药用水简介
制药用水通常指制药工艺过程中用到的各种质量标准的水。制药用水是制药生产过程的重要原料,参与了整个生产工艺过程,包括原料生产、分离纯化、成品制备、洗涤过程、清洗过程和消毒过程等。因此,在制药生产过程中,制药用水系统是至关重要的组成部分。
制药用蒸汽系统是湿热灭菌的一种介质,主要应用于注射用水系统、湿热灭菌柜、生物反应器、配液罐、管路系统、过滤器等重要设备与系统的灭菌。常见的制药用蒸汽系统主要为纯蒸汽系统,纯蒸汽的冷凝水直接与设备或物品表面接触,或者接触到用以分析物品性质的物料,纯蒸汽冷凝后的水质需满足注射用水质量标准,因此,制药用蒸汽系统也是医药行业无菌生产工艺过程中一个非常重要的组成部分。
制药用水和制药用蒸汽的质量从药品生产质量管理规范(GMP)和药典的角度来看非常重要,从良好的工程管理规范(GEP)和经济的角度来看也同样重要,制药生产企业必须证明其所使用的制药用水系统与制药用蒸汽系统能始终如一地提供达到质量标准的制药用水与制药用蒸汽。
通常情况下,制药行业将制药用水系统与制药用蒸汽系统统称为制药用水系统,简称水系统。制备制药用水的本质是减少或消灭潜在的污染源,欧盟和WHO将制药用水中的杂质列为潜在杂质来源之一,基于这个问题的考虑,本书提出如何进行制药用水制备、储存与分配系统的设计并确保污染风险得到控制。
1.1 制药用水的分类
对制药用水的定义和用途,通常以药典为准,各国药典对制药用水通常有不同的定义、不同的用途规定。
从使用角度分类,制药用水主要分为散装水与包装水两大类。散装水特指制药生产企业按相关生产工艺自制的制药用水,例如,中国药典认可的散装水包括纯化水和注射用水;欧盟药典认可的散装水包括散装纯化水、草药提取用水和注射用水;美国药典认可的散装水包括散装纯化水、血液透析用水和注射用水等。包装水也称成品水,特指按制药工艺生产的包装成品水,例如,中国药典收录了灭菌注射用水;欧盟药典收录了包装纯化水和灭菌注射用水等;美国药典收录了抑菌注射用水、灭菌吸入用水、灭菌注射用水、灭菌冲洗用水和灭菌纯化水等多种产品水(表1)。

表1 制药用水的分类
灭菌注射用水为注射用水按照注射剂生产工艺制备所得,主要用于注射用灭菌粉末的溶剂、注射剂的稀释剂和检测溶剂等。例如,在细菌内毒素检查过程中,检查用水需使用内毒素含量小于0.015EU/ml(用于凝胶法)或0.005EU/ml(用于光度测定法)且对内毒素试验无干扰作用的灭菌注射用水。
客观来说,制药工艺过程中用到的各种质量标准的水并不仅仅局限于药典质量标准,制药用水还可分为药典水与非药典水两大类。
药典水特指被国家或组织收录的制药用水,而非药典水特指未被药典收录,但可用于制药生产的制药用水,例如饮用水、软化水、蒸馏水和反渗透水等。非药典水至少要符合饮用水的要求,通常还需要进行其他的加工以符合工艺要求,非药典水中可能会包含一些用于控制微生物而添加的物质,因而不必符合所有的药典要求。有时,非药典水会用其所采用的最终操作单元或关键纯化工艺来命名,例如,反渗透水;在其他情况下,非药典水可以用水的特殊质量属性来命名,例如,低内毒素水。值得注意的是,非药典水不一定比药典水的质量更差,事实上,如果应用需要,非药典水的质量可能比药典水的质量更高。通过合理的说明,非药典水也可应用到整个制药操作中,包括生产设备的清洗、实验室应用,以及作为原料药生产或合成的原料,但是,需要注意的是,药典制剂的配制必须使用药典水。无论是药典水还是非药典水,用户均应制定适宜的微生物限度标准,应根据产品的用途、产品本身的性质以及对用户潜在的危害来评估微生物在非无菌制剂中的重要性,并期望生产者根据所用制药用水的类型来制定适当的微生物数量的警戒限和行动限,这些限度的制定应基于工艺要求和讨论的系统的历史记录。
1.2 水系统的组成
制药生产企业关心的制药用水主要是原料水,即纯化水、高纯水和注射用水等。从功能角度分类,制药用水系统主要由制备单元和储存与分配单元两部分组成(图1);制药用蒸汽系统主要由制备单元和分配单元两部分组成。
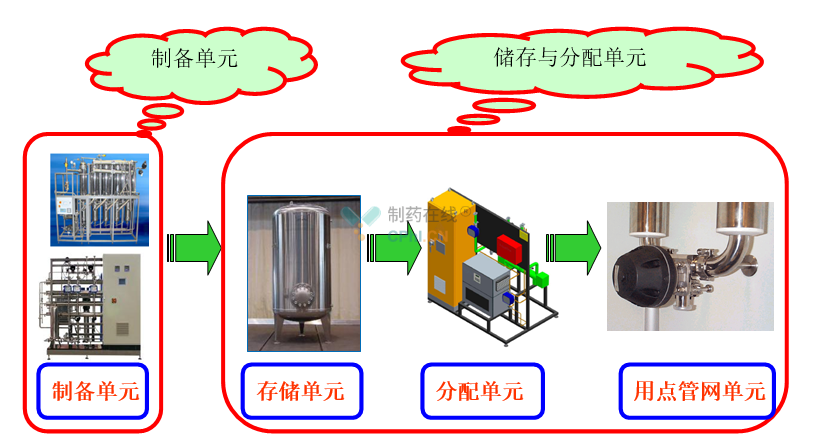
图1 制药用水系统的组成
制备单元主要包括软化水、纯化水机、高纯水机、蒸馏水机和纯蒸汽发生器,其主要功能为连续、稳定地将原水"净化"成符合企业内控指标或药典要求的制药用水;储存与分配单元主要包括储存单元、分配单元和用点管网单元,其主要功能为以一定缓冲能力,将制药用水输送到所需的工艺岗位,满足相应的流量、压力和温度等需求,并维持制药用水的质量始终符合药典要求。
制药用水极易滋生微生物,微生物指标是其最重要的质量指标之一。在制药用水系统的设计、安装、验证、运行和维护中需采取各种措施抑制其微生物的繁殖。鉴于制药用水在制药工业中既作为原料又作为清洗剂,且极易滋生微生物,各国药典对制药用水的质量标准和用途都有明确的定义和要求。制药用水与产品直接接触,其对药品的质量有着直接的影响,各个国家和组织的GMP将制药用水的制备和储存分配系统视为制药生产的关键系统,对其设计、安装、验证、运行和维护等提出了明确要求。
1.3 药典标准
药典是一个国家记载药品标准、规格的法典,一般由国家药品监督管理局主持编纂、颁布实施,国际性药典则由公认的国际组织或有关国家协商编订。到20世纪90年代初,世界上至少已有38个国家编订了国家药典,另外还有区域性药典3种及世界卫生组织编订的《国际药典》。药品标准是药品现代化生产和质量管理的重要组成部分,是药品生产、供应、使用和监督管理部门共同遵循的法定依据,制定药品标准对加强药品质量的监督管理、保证质量、保障用药安全有效、维护人民健康起着十分重要的作用。
药品质量的内涵包括三方面:真伪、纯度与品质优良度,三者的集中表现是使用中的有效性和安全性,因此,药品标准一般包括以下内容:法定名称、来源、性状、鉴别、纯度检查、含量(效价或活性)测定、类别、剂量、规格、贮藏、制剂等。纯化水与注射用水是制药生产过程中的重要原料,其质量的优劣将直接决定最终生产的药品质量,因此,各个国家或组织对其均有明确的规定。表2与表3列出了最新版中国药典、欧洲药典与美国药典关于散装纯化水和散装注射用水的不同质量标准。
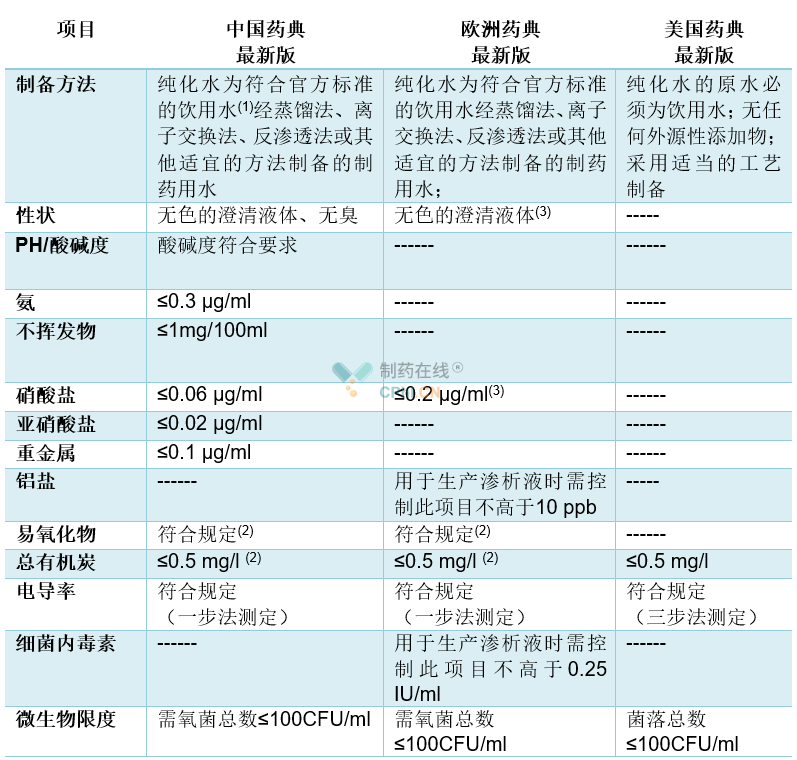
备注:
(1) 参见本章附录一《GB 5749-2006生活饮用水卫生标准》。
(2) 纯化水TOC检测法和易氧化物检测法两项可选做一项。
(3) 散装纯化水电导率不符合散装注射用水(0619)规定时,则根据5.20章节进行元素杂质风险评估。
表2散装纯化水的质量对照表
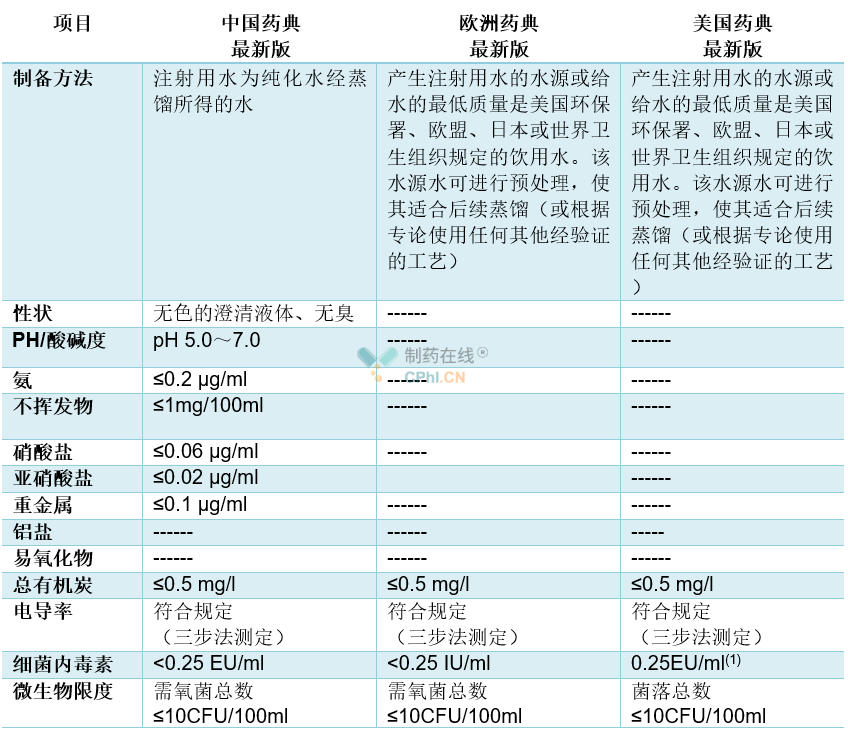
备注:(1)商业用途的散装注射用水。
表3散装注射用水的质量对照表
1.4 中国药典与制药用水
中国药典(Chinese Pharmacopoeia,CP)的最新版本为2020年12月30日即将正式实施的2020版《中国药典》。与2015 年版《中国药典》一样,2020年版《中国药典》由四部组成,一部为中药,二部为化学药品,三部为生物制品,四部为通则和辅料标准。2020版《中国药典》新增319种,修订3177种,不再收载10种,品种调整合并4种,共收载品种5911种。一部中药收载2711种,其中新增117种、修订452种。二部化学药收载2712种,其中新增117种、修订2387种。三部生物制品收载153种,其中新增20种、修订126种;新增生物制品通则2个、总论4个。四部收载通用技术要求361个,其中制剂通则38个(修订35个)、检测方法及其他通则281个(新增35个、修订51个)、指导原则42个(新增12个、修订12个);药用辅料收载335种,其中新增65种、修订212种。
中国药典中所收载的制药用水包括纯化水、注射用水及灭菌注射用水,与2015版《中国药典》相比,2020版《中国药典》在制药用水相关规定上没有变化。
2020版《中国药典》纯化水质量应符合二部中关于纯化水的相关规定,纯化水可作为配制普通药物制剂用的溶剂或实验用水;可作为中药注射剂、滴眼剂等灭菌制剂所用药材的提取溶剂;口服、外用制剂配制用溶剂或稀释剂;非灭菌制剂用器具的精洗用水;也可用作为非灭菌制剂所用药材的提取溶剂。纯化水不得用于注射剂的配制与稀释。纯化水有多种制备方法,应严格监测各生产环节、防止微生物污染、确保使用点的水质。2020版《中国药典》关于纯化水的质量标准参见如下内容:
纯化水
Chunhuashui
Purified Water
H2O 18.02
本品为饮用水经蒸馏法、离子交换法、反渗透法或其他适宜的方法制得的制药用水,不含任何添加剂。
【性状】 本品为无色的澄清液体;无臭。
【检査】 酸碱度 取本品10ml,加甲基红指示液2滴,不得显红色;另取10ml,加溴麝香草酚蓝指示液5滴,不得显蓝色。
硝酸盐 取本品5ml置试管中,于冰浴中冷却,加10%氯化钾溶液0.4ml与0.1%二苯胺硫酸溶液0.1ml,摇匀,缓缓滴加硫酸5ml,摇匀,将试管于50℃水浴中放置15分钟,溶液产生的蓝色与标准硝酸盐溶液[取硝酸钾0.163g,加水溶解并稀释至100ml,摇匀,精密量取1ml,加水稀释成100ml,再精密量取10ml,加水稀释成100ml,摇匀,即得(每1ml相当于1μgNO3)]0.3ml,加无硝酸盐的水4.7ml,用同一方法处理后的颜色比较,不得更深(0.000 006%)。
亚硝酸盐 取本品10ml,置纳氏管中,加对氨基苯磺酰胺的稀盐酸溶液(1→100)1ml与盐酸萘乙二胺溶液(0.1→100)1ml,产生的粉红色,与标准亚硝酸盐溶液[取亚硝酸钾0.750g(按干燥品计算),加水溶解,稀释至100ml,摇匀,精密量取1ml,加水稀释成100ml,再精密量取1ml,加水稀释成50ml,摇匀,即得(每1ml相当于1μgNO2)]0.2ml,加无亚硝酸盐的水9.8ml,用同一方法处理后的颜色比较,不得更深(0. 000 002% )。
氨 取本品50ml,加碱性碘 化 汞钾试液2ml,放置15分钟;如显色,与氯化铵溶液(取氯化铵31.5mg,加无氨水适量使溶解并稀释成1000ml)1.5ml,加无氨水48ml与碱性碘 化 汞钾试液2ml制成的对照液比较,不得更深(0.000 03%)。
电导率 应符合规定(通则0681)。
总有机碳 不得过0.50mg/L(通则0682)。
易氧化物 取本品100ml,加稀硫酸10ml,煮沸后,加高锰酸钾滴定液(0.02mol/L)0.10ml,再煮沸10分钟,粉红色不得完全消失。
以上总有机碳和易氧化物两项可选做一项。
不挥发物 取本品100ml,置105℃恒重的蒸发皿中,在水浴上蒸干,并在105℃干燥至恒重,遗留残渣不得过1mg。
重金属 取本品100ml,加水19ml,蒸发至20ml,放冷,加醋酸盐缓冲液(pH3.5)2ml与水适量使成25ml,加硫代乙酰胺试液2ml,摇匀,放置2分钟,与标准铅溶液,1.0ml加水19ml用同一方法处理后的颜色比较,不得更深(0.000 01%)。
微生物限度 取本品不少于1ml,经薄膜过滤法处理,采用R2A琼脂培养基,30〜35 ℃培养不少于5天,依法检査(通则1105),1ml供试品中需氧菌总数不得过100cfu。
R2A琼脂培养基处方及制备
酵母浸出粉 0.5g
蛋白胨 0.5g
酪蛋白水解物 0.5g
葡萄糖 0.5g
可溶性淀粉 0.5g
磷酸氢二钾 0.3g
无水硫酸镁 0.024g
丙酮酸钠 0.3g
琼脂 15g
纯化水 1000ml
除葡萄糖、琼脂外,取上述成分,混合,微温溶解,调节pH值使加热后在25 ℃的pH值为7.2±0.2,加人琼脂,加热溶化后,再加人葡萄糖,摇匀,分装,灭菌。
R2A琼脂培养基适用性检查试验 照非无菌产品微生物限度检査:微生物计数法(通则1105)中"计数培养基适用性检查"的胰酪大豆胨琼脂培养基的适用性检査方法进行,试验菌株为铜绿假单胞菌和枯草芽孢杆菌。应符合规定。
【类别】 溶剂、稀释剂。
【贮藏】 密闭保存。
2020版《中国药典》注射用水质量应符合二部中关于注射用水的相关规定,注射用水必须在抑制细菌内毒素产生的条件下制备、储存与分配。注射用水可作为配制注射剂、滴眼剂等无菌剂型的溶剂或稀释剂,以及容器的精洗。为保证注射用水的质量,应减少原水中的细菌内毒素,监控蒸馏法制备注射用水的各生产环节并防止微生物的污染,应定期清洗与消毒注射用水系统。注射用水的储存方式应经过验证,确保水质符合质量要求,例如,推荐用户在70℃以上保温循环。2020版《中国药典》关于注射用水的质量标准参见如下内容:
注射用水
Zhusheyong Shui
Water for Injection
本品为纯化水经蒸馏所得的水。
【性状】 本品为无色的澄明液体;无臭。
【检査】 pH值 取本品100ml,加饱和氯化钾溶液0.3ml,依法测定(通则0631),pH值应为5.0〜7.0。
氨 取本品50ml,照纯化水项下的方法检査,但对照用氯化铵溶液改为1.0ml,应符合规定(0.000 02% ) 。
硝酸盐与亚硝酸盐、电导率、总有机碳、不挥发物与重金属 照纯化水项下的方法检查,应符合规定。
细菌内毒素 取本品,依法检查(通则1143),每1ml中含内毒素的量应小于0.25EU。
微生物限度 取本品不少于100ml,经薄膜过滤法处理,采用R2A琼脂培养基,30〜35 ℃培养不少于5天,依法检査(通则1105),100ml供试品中需氧菌总数不得过10cfu。
R2A琼脂培养基处方、制备及适用性检查试验照纯化水项下的方法检查,应符合规定。
【类别】 溶剂。
【贮藏】 密闭保存。
2020版《中国药典》灭菌注射用水质量应符合二部中关于灭菌注射用水的相关规定,中国药典灭菌注射用水不含任何添加剂,主要用于注射用灭菌粉末的溶剂或注射剂的稀释剂,其质量符合中国药典关于灭菌注射用水的相关规定。灭菌注射用水灌装规格应适应临床需要,避免大规格、多次使用造成的污染。2020版《中国药典》关于灭菌注射用水的质量标准参见如下内容:
灭菌注射用水
Miejun Zhusheyong Shui
Sterile Water for Injection
本品为注射用水照注射剂生产工艺制备所得。
【性状】 本品为无色的澄明液体;无臭。
【检査】 pH值 取本品100ml,加饱和氯化钾溶液0.3ml,依法测定(通则0631),pH值应为5.0〜7.0。
氯化物、硫酸盐与钙盐 取本品,分置三支试管中,每管各50ml,第一管中加硝酸5滴与硝酸银试液1ml,第二管中加氯化钡试液5ml,第三管中加草酸铵试液2ml,均不得发生浑浊。
二氧化碳 取本品25ml,置50ml具塞量筒中,加氢氧化钙试液25ml,密塞振摇,放置,1小时内不得发生浑浊。
易氧化物 取本品100ml,加稀硫酸10ml,煮沸后,加高锰酸钾滴定液(0.02mol/L)0.10ml,再煮沸10分钟,粉红色不得完全消失。
硝酸盐与亚硝酸盐、氨、电导率、不挥发物、重金属与细菌内毒素 照注射用水项下的方法检查,应符合规定。
其他应符合注射剂项下有关的各项规定(通则0102)。
【类别】 溶剂、冲洗剂。
【规格】 (1)1ml (2)2ml (3)3ml (4)5ml (5)10ml (6)20ml (7)50ml (8)500ml (9)1000ml (10)3000ml(冲洗用)
【贮藏】 密闭保存。
1.5 中国GMP与制药用水
《中国GMP》(2010版)在"第五章 设备"的第六节中对制药用水有明确的规定,具体如下:
第九十六条 制药用水应当适合其用途,并符合《中华人民共和国药典》的质量标准及相关要求。制药用水至少应当采用饮用水。
第九十七条 水处理设备及其输送系统的设计、安装、运行和维护应当确保制药用水达到设定的质量标准。水处理设备的运行不得超出其设计能力。
第九十八条 纯化水、注射用水储罐和输送管道所用材料应当无毒、耐腐蚀;储罐的通气口应当安装不脱落纤维的疏水性除菌滤器;管道的设计和安装应当避免死角、盲管。
第九十九条 纯化水、注射用水的制备、储存和分配应当能够防止微生物的滋生。纯化水可采用循环,注射用水可采用70℃以上保温循环。
第一百条 应当对制药用水及原水的水质进行定期监测,并有相应的记录。
第一百零一条 应当按照操作规程对纯化水、注射用水管道进行清洗消毒,并有相关记录。发现制药用水微生物污染达到警戒限度、纠偏限度时应当按照操作规程处理。
在《中国GMP》(2010版)"附录一 无菌药品"中,对制药用水细菌内毒素的监测要求如下:
第五十条 必要时,应当定期监测制药用水的细菌内毒素,保存监测结果及所采取纠偏措施的相关记录。
• 与《中国GMP》(1998版)相比,《中国GMP》(2010版)对制药用水的要求更加接近欧盟GMP对制药用水的要求,新版药典采用更科学的方法来检测水质质量,引入电导和TOC等国外流行的检测指标。同时,《中国GMP》(2010版)采用"过程控制"分析理念,强调纯化水、注射用水的制备、储存和分配应当能够防止微生物的滋生,取消了对制药用水运行温度的强制约束;另外,《中国GMP》(2010版)建议采用便于趋势分析的方法保存数据,如制药用水的电导、TOC、温度和微生物监测数据等,强调自动化控制与记录等方法的重要性,强调文件系统和整个系统的可追溯性。与此同时,国家标准《GB 50913-2013 医药工艺用水系统设计规范》与《水系统GMP实施指南(2010版)》等行业标准也为中国制药用水系统的设计、建造、调试、验证与维护提供了技术参考与法规建议。〜
第2节 作者简介
张功臣
2020版中国药典制药用水课题组专家
中国**行业协会设备与材料分会秘书长
中国政府节能创新型制药装备及水处理发展顾问
张功臣,制药行业专家,毕业于武汉工程大学与华中科技大学,致力于推动中国医药健康与水处理行业的科学发展,服务人类健康,现为中国政府节能创新型制药装备及水处理发展顾问,2020版中国药典通则0261制药用水课题组专家,国家标准《GB50913-2013 医药工艺用水系统设计规范》编委,制药用水与生物工艺系统"疑难杂症"资深诊断分析师,全国大学生制药工程设计竞赛委员会专家,国际制药工程协会(ISPE)水与蒸汽系统课题培训专家,国家市场监督管理总局检查员培训专家,中国**行业协会设备与材料分会秘书长,山东省医药行业协会GMP评估专家,蒲公英特约撰稿人,E药研发特约培训专家。
参与编写了国家标准《GB50913-2013 医药工艺用水系统设计规范》,组织编写了《制药用水系统》《Pharmaceutical Water Systems》《制药流体工艺实施手册》《制药除锈工艺实施手册》等专业著作,作为编者编写了《制药工程工艺设计》《绿色制药技术》《药物制剂过程装备与工程设计》《制药工艺验证实施手册》和《制药洁净室微生物控制》等多部教材书籍,并参与编写了全国高等学校制药工程专业规划教材《化工制图》、《药品生产管理规范教程》和《制药设备与工艺》等。
中国最早认知并开发除锈再钝化服务的制药工程专家。主要研究领域为制药用水与生物工艺系统,在生物单抗、蛋白类药物、重组人胰岛素、胰岛素类似物、人用**、兽用**、血液制品、无菌制剂和制药用水系统等方面有着丰富经验,组织设计与实践的国内外制药用水、无菌与生物制品类的项目超1200个。组织设计并实践的无菌与生物制药项目包括上海生物所、兰州生物所、金赛生物、友博生物、康弘生物、药明康德、成都生物所、信达生物、齐鲁生物、华兰生物、通化东宝、健亚生物、申联生物、上海君实生物、宜都东阳光、天士力药业、湖州特瑞斯、莱氏血制、复宏汉霖、凯茂生物、仁会生物、勃林格英格翰、天坛生物、卫武光明生物、荣昌生物、迈百瑞生物、普罗吉生物、新昌药业、海正药业、华海药业、人福药业、马应龙药业、扬子江海岸、哈药总厂、南京奥赛康药业、南京先声药业、美国宝洁、英国利杰时等。



合作咨询
![]() 肖女士
肖女士
![]() 021-33392297
021-33392297
![]() Kelly.Xiao@imsinoexpo.com
Kelly.Xiao@imsinoexpo.com
 2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57
2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57