【作者简介】张功臣,中国药典制药用水标准体系课题组成员
对于全球制药用水标准体系的发展而言,欧盟药典注射用水专论<0169>的修订是一次小小的革命。自2017年4月1日正式生效以来,欧盟开始允许使用等同于蒸馏技术的方法来生产注射用水。与蒸馏技术生产注射用水相比较,膜分离技术在经济性和生态环保性能方面都更具优势,也更加高效,这是因为过程中省去了生产工业蒸汽所需的许多设备,节约了大量的能源,注射用水的原水综合利用率高达85%,因此生产成本更低。欧洲药典制药用水的主要发展历程如下:
•1998-2000年,欧洲药典删除了大部分化学测试项,收录制药用水的电导率测定法,注射用水要求采用总有机碳测定法;
•2002年,美国药典、欧洲药典与日本药典同意开始对制药用水的部分内容进行协调统一,欧洲药典收录了高纯水;
•2004年7月1日,欧洲药典修订了电导率限度,收录透析用水;
•2017年4月1日,欧洲药典允许非蒸馏法制备注射用水;
•2019年,欧洲药典EP9.7删除了高纯水,新增了用于草药提取的提取用水。
(一)欧洲药典
药典是一个国家/地区记载药品标准与规格的官方法典,一般由国家/地区的药品监督管理局主持编纂、颁布实施,国际性药典则由公认的国际组织或有关国家协商编订。《欧洲药典》(European Pharmacopoeia,EP)为欧洲药品质量检测的唯一指导文献,所有药品和药用底物的生产厂家在欧洲范围内推销和使用的过程中,必须遵循《欧洲药典》的质量标准。《欧洲药典》由欧洲药品质量管理局(EDQM)负责出版和发行,欧洲药典委员会在1964年成立,并于1977年出版了第一版《欧洲药典》。2019年7月,第十版《欧洲药典》出版(EP10),EP10为最新版的制药用水质量标准(表1),于2020年1月生效。
表1 最新版欧洲药典的制药用水
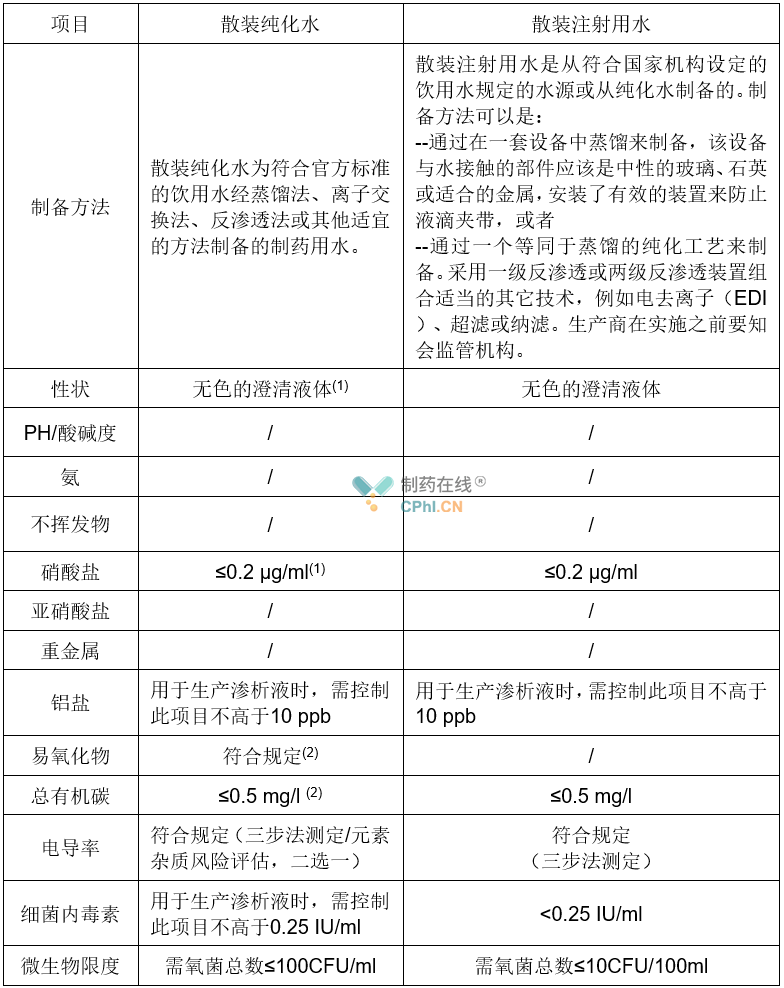
备注:(1) 欧洲药典规定:散装纯化水的电导率不符合散装注射用水(0619)规定时,则根据5.20章节进行元素杂质风险评估。(2) 纯化水TOC检测法和易氧化物检测法两项可选做一项。
(二)欧盟GMP及配套指南
EMA是European Medicines Agency的缩写,位于英国伦敦的欧盟药品管理机构。EMA对通过生物技术和其他高技术生产的药品进行集中评审,EEA也受理艾滋病、癌症、糖尿病或神经退化等疾病药 品和罕见病药的直接申报注册,其他各类新药的申请者在向某一国家申报注册批准后可以向EMA申请欧盟总体上市许可或推荐。EMA还向新药开发单位提供 技术和方案指导,出版关于质量、安全和疗效检测的指南文件。EMA与欧洲药典(EDQM)、世界卫生组织(WHO)、国际药品注册技术协调组织 (ICH)一起执行与实施共同的GMP标准和质量标准。
2014年8月13日,欧盟(EU)在其官方网站上发布了新修订的欧盟药品生产质量管理规范(EU GMP)第一部分"药品基本要求"中的第三章"厂房与设备"、第五章"生产"和第八章"投诉、质量缺陷与产品召回"。这三章已于2015年3月1日实施。其中,"厂房与设备"、"生产"两章均对制药设施及药品生产过程中的交叉污染提出了更加严格的要求。欧盟药品生产质量管理规范(EU GMP)第一部分"药品基本要求"在第三章"厂房与设备"的第3.43条规定:应根据书面程序对蒸馏水、去离子水和其他类型水的输送管道进行消毒,书面规程应描述微生物污染的超标限度和应采取的措施。
2014年9月1日正式实施的欧盟药品生产质量管理规范(EU GMP)第二部分"原料药"在第四章"厂房与设备"的4.3章节规定:原料药生产中使用的水应当证明适用于其预期的用途;除非另有说明,工艺用水最低限度应符合世界卫生组织(WHO)饮用水质量指南;如果饮用水不足以确保原料的质量,并要求更为严格的化学纯度和/或微生物限度标准,应当指定合适的物理/化学属性、微生物总数、不良微生物和/或内毒素的规格标准;如果工艺用水由生产商处理以达到规定的质量,则应对处理过程进行验证和监测,并规定适当的行动限制;当非无菌原料药生产商计划或声称其适合用于进一步加工生产无菌药品(药用的)时,最终分离和纯化工序中使用的水应当进行微生物总数、不良微生物和内毒素的监测与控制。
2020年2月20日,欧盟委员会健康与食品安全局发布了欧盟GMP附录一《无菌产品生产》进一步草案。新修订文件向相关组织和利益相关者征求意见,为期3个月。《EU GMP附录1:无菌药品生产》于1971年首次发布,新文件已将名字《无菌药品生产》改为《无菌产品生产》,文件适用的产品范围已大大扩展。2020年的《EU GMP附录1:无菌产品生产》最新征求意见稿关于制药用水的主要关注内容包括:
(1) 不再强调注射用水由纯化水制备,而是满足经过确认的标准(符合官方标准的饮用水或纯化水),修改是因为第一轮反馈意见认为强调由纯化水制备与全世界许多药典的要求不符;
(2) 注射用水的生产应使用符合验证过程中规定的规范,并以使微生物滋生风险最小化的方式(例如,通过在70°C以上的温度持续循环)来存储和分配。 如果注射用水是通过蒸馏以外的方法生产时,则应考虑将诸如纳滤、超滤以及电去离子(EDI)的其他技术与反渗透(RO)膜结合使用;
(3) 注射用水系统应包括连续监测系统,如总有机碳(TOC)和电导率(除非另有理由),因为这些系统可能比离散采样更好地显示整体系统性能。传感器位置应基于风险和鉴定结果。
(4) 用作直接灭菌剂的蒸汽应具有适当的质量,不应含有可能导致产品或设备污染的添加剂。对于提供用于对物料或产品接触表面进行直接灭菌的纯蒸汽的纯蒸汽发生器(例如,多孔的硬质高压灭菌器),蒸汽冷凝物应符合相关《药典》 注射用水的最新标准。应制定适当的采样时间表,以确保定期获取有代 表性的纯蒸汽样品进行分析。用于灭菌的纯蒸汽质量的其他方面应定期根据已验证的参数进行评估。这些参数应包括以下内容:不凝性气体,干度值(干度分数)和过热度。
2020年7月20日,欧洲药品管理局发布了新版《制药用水质量指南》并于2021年2月1日已正式生效,该指南将取代欧洲药品管理局对制药用水质量使用了近二十年历史的"制药用水质量指南说明"(CPMP/QWP/158/01 EMEA/CVMP/115/01)和 CPMP《注射**生产用水质量立场声明》(EMEA/CPMP/BWP/1571/02 rev.1)。该指南修改和解读如下:
(1) 更新当前对生产用于人类和兽用的活性物质和药品的最低可接受水质的期望;
(2) 反映欧洲药典的变化,包括修订的《注射用水》专论,允许使用除蒸馏以外的方法来生产可注射质量的水,并进行了大量细微的更改;
(3) 在该指南中,为三种等级的水设定了质量标准:注射用水<0169>,纯化水<0008>和提取用水<0765>。需要注意的是,高纯水已经从欧洲药典删除,新增了用于草药提取的提取用水。欧洲药品管理局还指出,饮用水虽然没有被药典专论所涵盖,但它"是生产药典级水的规定来源水";
(4) 指南本身就用于不同用途和应用的水的最低可接受质量提出了建议,包括生产无菌药品和非无菌药品,活性物质以及用于清洗和冲洗设备以及药品容器/盖的水;
(5) 该指南适用于人和兽用活性物质的生产,以及先进治疗药物(ATMP),对于新的上市许可申请和现有许可的变更,应符合该指南。"在相关的情况下,本指南的原则也可适用于研究性医药产品"。
【福利】




合作咨询
![]() 肖女士
肖女士
![]() 021-33392297
021-33392297
![]() Kelly.Xiao@imsinoexpo.com
Kelly.Xiao@imsinoexpo.com
 2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57
2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57