据CDE官网显示,信达生物制药(苏州)有限公司(以下简称“信达生物”)的1类新药IBI3004获得临床试验默示许可,适应症为结直肠癌等实体瘤。据公开资料显示,IBI3004是一款抗DR5/CEA双特异性抗体。

图片来源:CDE官网
结直肠癌在我国属于第二高发的癌种,也是全球第三大常见癌症。据Nature Reviews Drug Discovery上的一篇文章预测,2032年全球结直肠癌治疗药物的市场规模将达到103亿美元。
IBI3004是信达生物开发的一款DR5/CEA双抗,本次获得临床试验默示许可的适应症为结直肠癌等实体瘤。
据了解,死亡受体5(DR5)是位于细胞表面含有一个细胞外死亡结构域的受体,其在肿瘤组织与正常组织中的表达存在显著差异,是一种颇具前景的肿瘤治疗靶点。CEA(CEACAM5)最初被作为结直肠癌肿瘤标志物以帮助相关肿瘤诊断及检测,近年来随着对CEA的研究愈加深入,该靶点也开始作为肿瘤靶点用于新药开发。
目前,IBI3004已在海外开启临床研究。据Clinicaltrials官网显示,信达生物登记了一项Ⅰ/Ⅱ期临床试验,该研究拟评估IBI3004用于不可切除、局部晚期或转移性实体瘤患者,预计入组106位患者,计划2026年5月1日前完成。
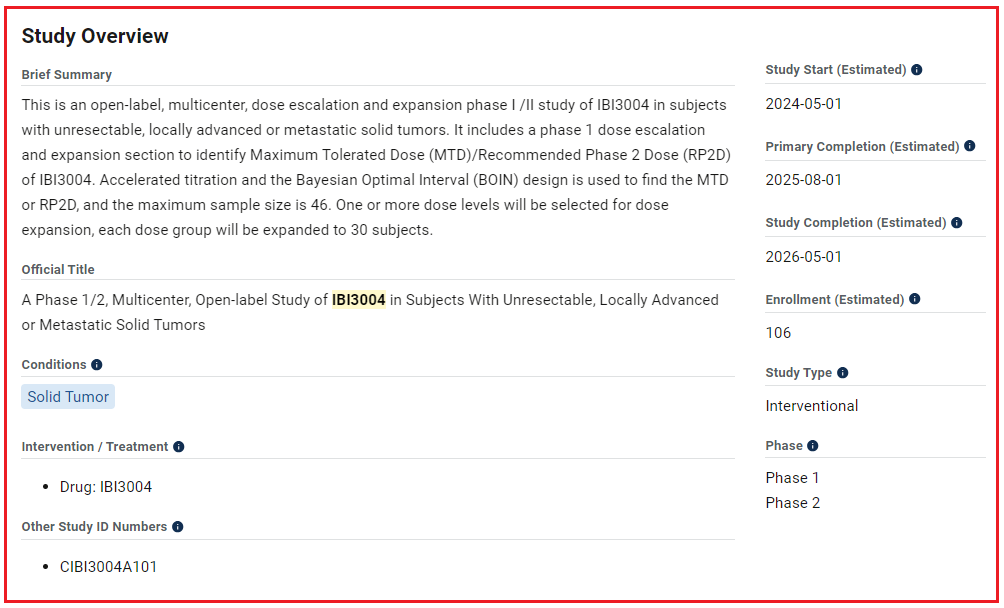
图片来源:Clinicaltrials.gov
2024开年以来,信达生物多款新药研发取得进展,包括PD-1/IL-2抗体融合蛋白IBI363、CLDN18.2/CD3双特异性抗体IBI389、B7-H3/EGFR双特异性抗体IBI334、GPRC5D/BCMA/CD3的三特异性抗体IBI3003等。



合作咨询
![]() 肖女士
肖女士
![]() 021-33392297
021-33392297
![]() Kelly.Xiao@imsinoexpo.com
Kelly.Xiao@imsinoexpo.com
 2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57
2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57