前言
癫痫是发病率的神经系统疾病之一,全世界有超过5000万人患有癫痫。发达国家的发病率约为每年40-70/10万人。在目前的治疗中,大约2/3的癫痫患者没有发生癫痫发作,但是对于另外的1/3癫痫患者,尽管已有数种抗癫痫药物(AEDs)可供使用,但仍然没有得到很好的控制。因此在癫痫治疗领域始终也我们在一直期盼着更加有效的新药的出现。
左乙拉西坦(Levetiracetam,简称LEV)是继续卡马西平、苯妥英钠、丙戊酸钠等传统抗癫痫药物之后的由比利时UCB公司开发的第二代新型抗癫痫药物(商品名Keppra?)。1999年12月正式批准用于16岁以上成人部分发作的辅助治疗,2005年6月又将适应症扩大到4岁以上儿童。左乙拉西坦凭借其独特的作用机制,对于成人癫痫部分发作治疗效果获得了肯定,且耐受性良好。
2016年1月14日和2016年2月18日欧洲医药管理局(EMA)和美国食品药品管理局(FDA)分别于批准了比利时UCB公司开发的第三代抗癫痫药物—布瓦西坦(Brivaracetam,简称BRV),商品名为Briviact?。用于治疗16岁及以上部分发作型的癫痫患者,辅助治疗伴随或不伴随继发全身性发作。
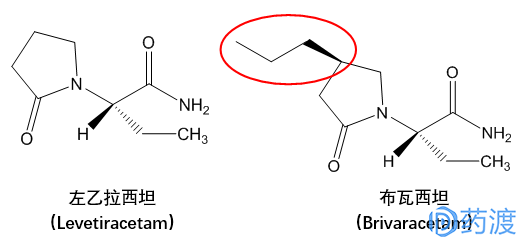
BRV和LEV的结构非常相似,都属于吡咯烷酮衍生物。BRV与LEV的化学结构相比,仅仅是在吡咯烷烃的4位上连接了一个正丙基。两个药物就像双子座一样相似,以至于第一次见到BRV时,误为这是一个伪创新产品,或者UCB公司为了延续LEV产品所来带的市场辉煌所做的延续性产品,且不论判断的正误或者研发的动机,BRV的发现背后还是存在着深入的药理机制研究,本文也正是想透过BRV的非临开发历程和与LEV的对比优势来透视此类新型抗癫痫药物独特的发现。
SV2A蛋白靶点的发现和认知对于新型抗癫痫药物开发的意义
LEV已经上市数十年,但事实上LEV对于常用的筛选新化合物的经典动物模型没有作用,这与其临床有效性相矛盾。因此LEV的发现已经引起了对当时开发研究方法的一些怀疑,并且增加了在这个研究领域的争论。
在BRV开发之前,作为LEV和BRV靶点的SV2A蛋白的作用还远远没有被完全理解。然而,BRV的开发证明了SV2A蛋白结合亲和力与抗癫痫作用之间的相关性,并且提高了此类抗癫痫药物成功开发的可能性。SV2A蛋白的鉴定和随后的临床前癫痫研究方法是影响该领域进展的一个里程碑,具有相当重大的意义。BRV的有效性也进一步强化了对这一观点和对新方法的需求。
SV2A蛋白的发现和BRV的后续开发进一步证实了这样一种印象:在过去的20年中,新的AEDs没有一个能够提高癫痫治愈患者的比例,是因为目前的药物开发所采用的相同动物模型几乎都是基于相同的假设和理论基础。因此,为了探索新的目标药物,迫切需要新创新的癫痫临床前开发模型。
1. SV2A蛋白的发现叩开了新型癫痫药物开发的大门
SV2蛋白是存在于神经元和内分泌细胞突触囊泡中的原型蛋白质,具有12-跨膜结构,并由三种亚型SV2A、SV2B和SV2C组成。在SV2亚型中,SV2A在包括大脑皮层、海马和小脑在内的所有脑区域高度表达,但是也由神经内分泌细胞和神经肌肉接头表达,已有研究结果表明SV2A可以调节突触小泡的胞吐作用和突触前神经递质的释放。
BRV的发现和非临床开发与SV2A蛋白的发现有着紧密的联系,也与第一种显示与SV2A蛋白结合的AED药物LEV的发现有紧密的联系。在非临床研究中,LEV在癫痫发作模型中显示出对听源性和点燃性癫痫发作、6-Hz电休克和棘波放电具有保护作用。但在用于AED发现的标准动物模型——电休克(MES)和戊四氮(PTZ)的模型中显示出无效。LEV的非临床特征与临床研究显示的广谱有效性虽然相关,但其非典型抗癫痫特性表明LEV具有与传统AED不同的作用机制。相关研究随后揭示了LEV与SV2A蛋白的可逆的,饱和的和立体选择性的结合,导致突触小泡的胞吐减少和兴奋性突触中癫痫活动期间诱发率降低的增加。从那时起,研究集中在发现靶向SV2A蛋白的新药物上,最终导致BRV的开发。
2. SV2A蛋白是抗癫痫药物的潜在好靶点
一些动物研究表明,SV2A蛋白是控制癫痫发作的一个潜在好靶点。
SV2A敲除小鼠不能生长和产生自发性癫痫发作,会在出生后2-3周内死亡。而杂合性SV2A敲除小鼠不显示自发性癫痫发作,而显示预癫痫特征,例如增强了对毛果芸香碱和卡因酸(Kainate)预惊厥作用的敏感性,减少6-Hz癫痫发作的阈值和角膜点燃的增加率。对来自SV2A敲除小鼠的培养的神经元的研究表明由于较低的初始囊泡释放概率和刺激期间神经递质释放的减少,突触后反应降低。
在癫痫发作的动物模型和从癫痫患者获得的脑组织中发现了SV2A蛋白表达和功能改变,这表明SV2A蛋白表达/功能的降低促成了癫痫的进展。
SV2A蛋白的结合与不同癫痫发作的非临床模型(如听觉癫痫发作小鼠)中的抗癫痫作用紧密相关,并且SV2A蛋白水平的下降似乎还涉及耐药性癫痫的机制。
所有这些证据一起表明,SV2A蛋白明确涉及癫痫的发病机制,因此可以在其治疗中发挥作用。然而,SV2A的详细功能和机制(例如神经递质特异性)仍不清楚。
BRV的发现历程
正如已经提到的那样,SV2A蛋白作为LEV主要分子靶标的发现以及随后对于癫痫治疗潜在作用的证据促成了SV2A机制新药的发现和优化程序。
新的目标是确定比LEV能更完全抑制癫痫发作的高选择性和更有效的SV2A配体。在体外筛选了约12000种化合物的SV2A结合亲和力,进一步筛选了其中的1200种化合物对体内惊厥发作易感小鼠的癫痫发作保护作用。最后选择了约30个化合物,并在不同的癫痫动物模型中进行了大量表征。这些研究发现,LEV吡咯烷环4位上的取代可以增强结合亲和力。在对这个位点进行基团替换的系统研究中发现,与LEV相比,各种小的疏水基团具有更强的SV2A亲和力。并且在听觉癫痫发作试验中增强了活性。在具有增强结合亲和力的类似物中,最终选择了分子量为212的与LEV结构相近的2-吡咯烷酮衍生物BRV作为药物开发候选物。
BRV的非临床特点
1. BRV具有更高的SV2A蛋白选择性和结合力
BRV是具有SV2A高度选择性和可逆性的配体,具有优于LEV的抑制突触传递和囊泡释放的亲和能力。此外,来自SV2A敲除小鼠的研究结果显示,直至600nM(测试的浓度)的浓度,[3H]BRV具有仅标记SV2A蛋白的高度选择性。大鼠和人脑中[3H]BRV的体外结合显示,BRV对大鼠和人SV2A显示出了与LEV类似的亲和力(Kd为62nM);然而对应于在癫痫动物模型和人脑切片研究中的突触前SV2A,BRV对于突触后SV2A显示出比LEV高出约15-30倍的亲和力。在治疗相关剂量下,BRV占据大脑中SV2A的80%至>90%。小鼠脑中的离体结合实验显示,BRV在给药后5-15分钟内达到SV2A占有率,在该时间范围内也显示出对癫痫发作的保护作用。
2. BRV具有更快的脑部渗透速度
BRV具有比LEV (LogD 0.64)更高的亲脂性(LogD 1.04),导致更快的脑部渗透速度,这与癫痫发作小鼠模型中的快速保护作用相对应。LEV的预测药物进入半衰期为23分钟,而BRV仅为3分钟,在药物渗透入脑的速度上观察到约7倍的差异。同样,在相同听觉小鼠模型中的离体结合研究显示,BRV腹膜内(i.p.)给药后5-15分钟内观察到SV2A的占有率和活性,而LEV为30-60分钟。因此,可以更快进入大脑的BRV具有较短的作用潜伏期,这对于例如癫痫持续状态(SE)或癫痫集群性发作的临床紧急治疗情况具有十分重要的意义。
3. BRV具有更低的有效剂量
使用高频神经元刺激来比较BRV和LEV的大鼠海马切片研究表明,BRV增强突触抑制,并且可以在比LEV低100倍的浓度下来减少突触传递。另外,BRV在减少突触小泡动员方面比LEV更有效。
4. BRV具有更高的治疗指数
BRV虽然显示出低的治疗指数(在完全点燃发作动物的旋转杆测试中运动损伤的TD50与在相同动物中针对广义运动癫痫发作保护的ED50之间的比率),但仍然比LEV高(148比46)。在杏仁核点燃大鼠的旋转试验中,BRV具有比LEV更高的治疗指数(4比2)。然而,它明显高于经典的和其他新型抗癫痫药物(治疗指数从2到21)。
5. BRV具有更强的抗癫痫潜力和有效性
体外研究表明,在两个不同的体外大鼠海马切片癫痫模型中,BRV具有比LEV更强的抗癫痫潜力和有效性,其剂量范围与其临床有效性相关。与LEV相比,BRV对SV2A亲和力的增加与在不同的癫痫体内模型中观察到的对癫痫保护作用的显著有效性相关。BRV的有效性已经在包括听觉小鼠、斯特拉斯堡(GAERS)遗传失神癫痫大鼠、杏仁核和角膜点燃模型以及缺氧后肌肉细胞的大鼠模型的部分和全面癫痫发作模型中进行了研究。在这些模型中,BRV始终如一地表现出比LEV更有效和更全面的抑制癫痫发作。特别是,在杏仁核鼠中,BRV (6.8-210mg/kg)剂量依赖性地降低癫痫发作严重性,在测试剂量下几乎完全抑制了癫痫发作。相比之下,即使在高剂量下,LEV (17-540mg/kg)也仅能提供有限的保护。在完全杏仁核点燃的大鼠中,BRV还能更全面地抑制运动发作的严重程度和放电后的持续时间。特别是,BRV对于严重运动发作的抑制剂量为21.2mg/kg,而LEV只有达到170mg/kg的剂量才能产生类似效果。在测试剂量(212.3mg/kg)下,BRV也显著降低后续放电持续时间,而LEV即使超过1700mg/kg,对此指标也没有任何影响。
6. SV2A蛋白相互作用的个体差异
在几种癫痫动物模型中,BRV与LEV相比所具有的更高有效性也可能是由于与SV2A蛋白相互作用的个体差异。事实上,使用SV2A变构调节剂的研究表明,BRV与SV2A的相互作用不同于LEV,BRV可能会诱导或稳定不同的SV2A蛋白质构象,这可能提供BRV与LEV相比所不同药效学性质的分子原理。实际上,LEV和BRV作用于不同的结合位点或与SV2A蛋白具有不同构象状态的相互作用。这可能解释了来自大鼠海马切片的电生理学研究的发现,其显示BRV具有更大的抑制突触传递和囊泡释放能力。
小结
BRV已经在许多癫痫实验模型中显示出优异的抗癫痫活性,并且作为疾病改善作用方面具有一定的前景。临床前研究表明,与LEV相比,BRV具有更高的有效性,因为其具有更高的选择性,更高的亲和力和不同于SV2A的结合特性,以及与更快速的脑渗透相关的亲脂性。正是基于这些研究发现,触发了进一步临床开发BRV的决定。虽然目前尚无临床研究支持BRV优于LEV有效性的证据,我们也期待着BRV与LEV的头对头临床研究来确证BRV的临床优势。
参考文献
Emilio Russo, Rita Citraro & Marco Mula (2017) The preclinical discovery and development of brivaracetam for the treatment of focal epilepsy, Expert Opinion on Drug Discovery, 12:11, 1169-1178, DOI: 10.1080/17460441.2017.1366985



合作咨询
![]() 肖女士
肖女士
![]() 021-33392297
021-33392297
![]() Kelly.Xiao@imsinoexpo.com
Kelly.Xiao@imsinoexpo.com
 2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57
2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57