异柠檬酸脱氢酶(IDH)
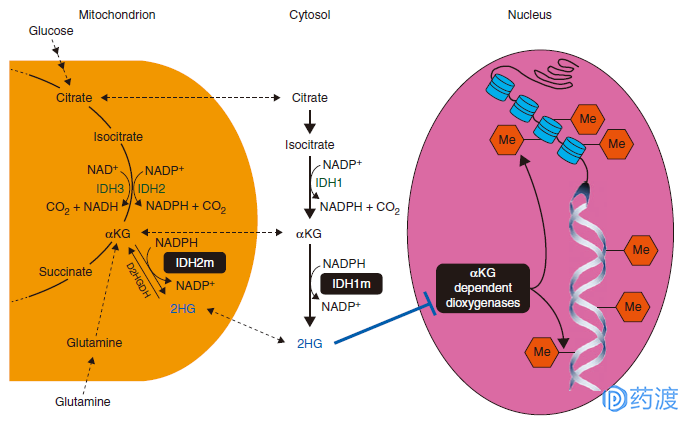
异柠檬酸脱氢酶(Isocitrate dehydrogenase,IDH)是参与细胞能量代谢的三羧酸循环中的限速酶,催化异柠檬酸氧化脱羧生成α-酮戊二酸(α-Ketoglutarate,α-KG)及CO2。人体中有3种IDH酶,分别是细胞质中的NADP-IDH1,线粒体中的NADP-IDH2和线粒体中的NAD-IDH3。
IDH突变是一些组织癌变的原因之一,在多种肿瘤(包括急性骨髓性白血病(AML)、神经胶质瘤、软骨肉瘤和胆管癌)中,均发现了IDH1和IDH2突变。肿瘤细胞中IDH突变(IDH1m和IDH2m)会导致其正常功能缺失,并将α-KG转化为致癌代谢物2-羟基戊二酸(2HG),2HG在突变的肿瘤细胞中累积,导致DNA或组蛋白过甲基化。IDH抑制剂通过作用于肿瘤细胞中的IDH突变位点,使体内致癌代谢物2HG减少,从而诱导组蛋白去甲基化,达到抑制肿瘤发展的效果。IDH抑制剂根据作用靶点分为IDH1抑制剂、IDH2抑制剂和IDH1/IDH2抑制剂三种。
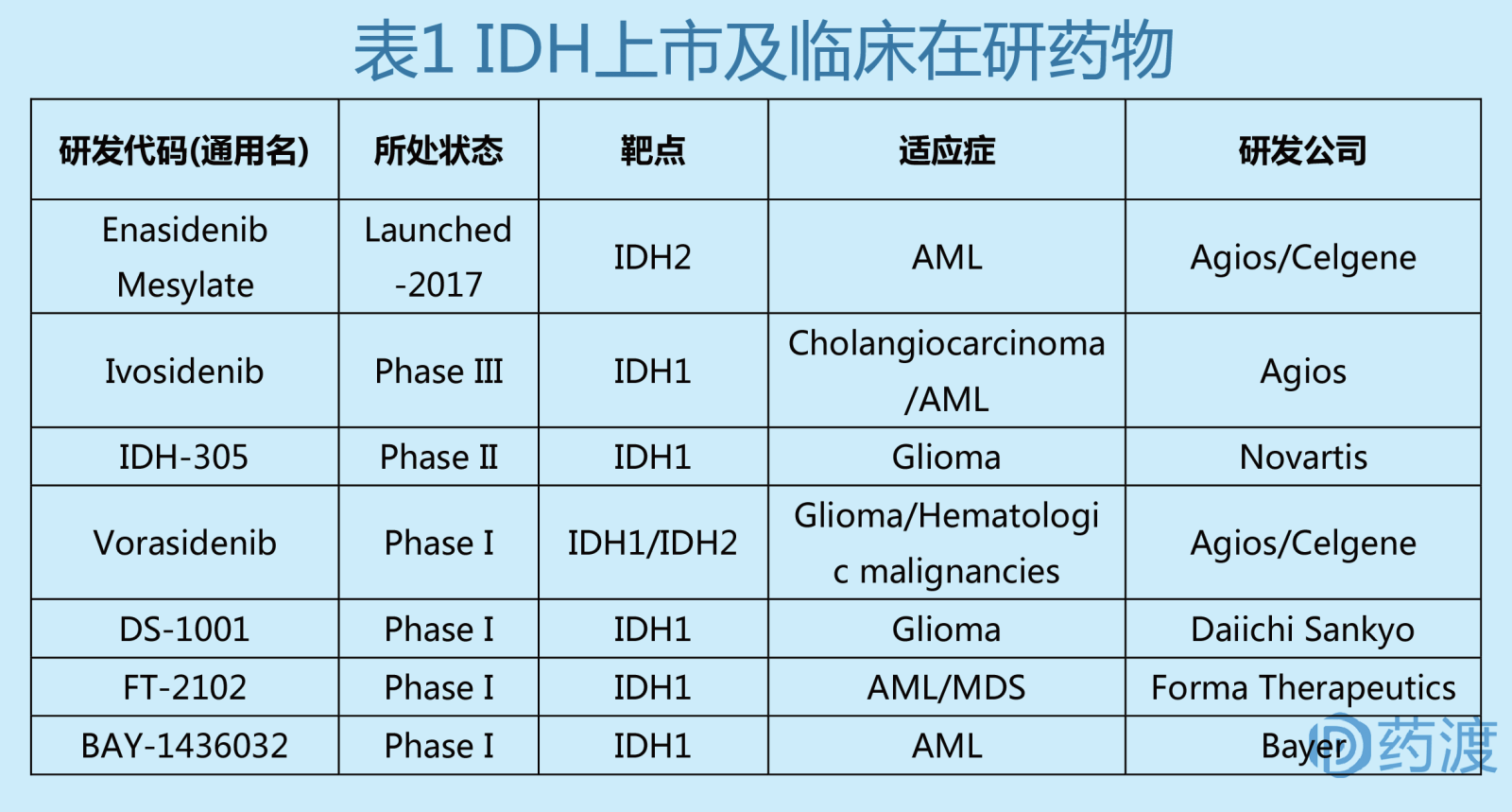
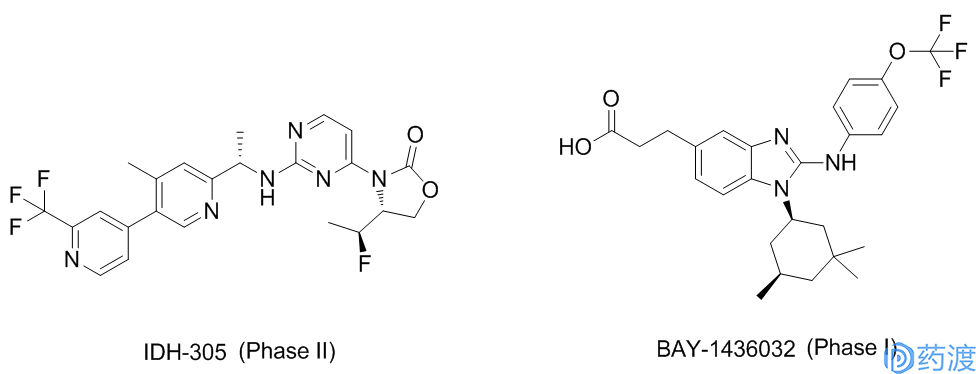
急性骨髓性白血病(AML)是一种造血系统的恶性疾病,病情发展迅速,预后较差。根据美国国家癌症研究所(NCI)统计,今年约有21380人被诊断为AML,还有10590人会死于AML。在AML中,大约有8%-19%的患者带有IDH2突变,这种突变会抑制正常的细胞发育。神经胶质瘤是颅内最常见的恶性肿瘤,约占全部颅内肿瘤的40%-50%,研究发现IDH1的基因突变在继发性神经胶质瘤中的突变频率高达75%以上。市场需求决定研发方向,Agios公司已经率先研发出IDH1抑制剂AGI-5198(临床前)和AG-120,IDH2抑制剂AGI-6780(临床前)和AG-221,以及IDH1/IDH2抑制剂AG-881。此外,其他公司和机构也研发出了IDH抑制剂,如BAY-1436032、IDH-305、FT-2102和DS-1001。
IDH作用机理图
IDH2抑制剂
Enasidenib Mesylate (AG-221)
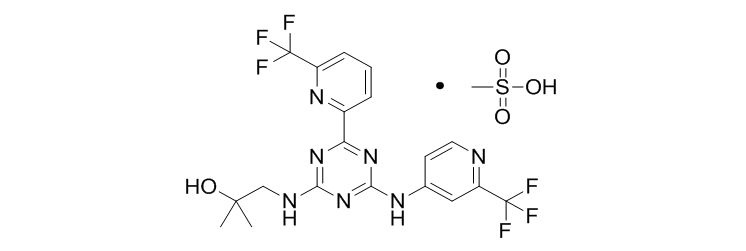
Enasidenib由Celgene与Agios Pharmaceuticals共同研发,于2017年8月1日获美国FDA批准上市,商品名为Idhifa?,用于治疗IDH2突变的、复发性或难治性急性髓系白血病(AML)。Enasidenib是首个IDH2抑制剂,也是首个针对肿瘤代谢的抗癌药物。据悉,Agios公司于2009年开始立项,2013年便推入临床。由于Enasidenib在临床试验中表现出来的优异性,该公司在2014年8月拿到了快速审批通道资格,4年后就被批准上市。Enasidenib目前也已经进军中国市场,正在开展临床一期试验。
Enasidenib的批准是基于一项公开、单臂、多中心的临床试验(NCT01915498),该试验中招募了199例携带IDH2突变的复发或难治性AML患者,且这些患者中至少有一半曾接受过2项或更多的抗癌疗法。研究中,患者接受每日100mg的初始剂量,直至病情出现进展,或出现无法接受的**。结果显示,约19% (n=37) (95%CI:13%,25%)的患者实现完全缓解(CR),中位缓解持续时间(Median DOR)为8.2个月(95% CI:4.7%,19.4%);4% (n=9) (95% CI:2%,8%)的患者实现部分血液学缓解(CRh),中位缓解持续时间(Median DOR)为9.6个月(95%CI:0.7%,NA)。在157例因为AML需要输血或血小板的患者中,在接受Enasidenib治疗后有34%不再需要输血。
Enasidenib的三期临床(IDHENTIFY;NCT02577406)是一个国际的、多中心的、开放的、随机临床试验,于2015年10月开始招募患者,该试验是将Enasidenib与传统支持疗法进行有效性和安全性对比,主要临床终点为总生存期(OS),该试验目前还在进行中。

Enasidenib研发里程碑
IDH1抑制剂
Ivosidenib (AG-120)
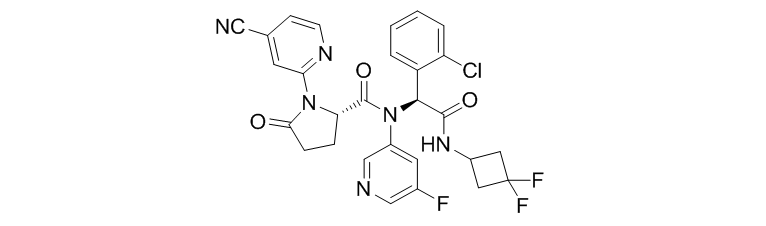
Ivosidenib (AG-120)是由Agios Pharmaceuticals研发的一款IDH1抑制剂,处于临床三期研究阶段。拟用于治疗胆管癌和复发、难治性急性髓性白血病。目前美国FDA已经授予Ivosidenib 孤儿药以及快速审评资格。
在一项早期的I/II临床试验中,研究人员招募了125名复发性或难治性AML患者。在接受至少6个月的治疗后,达到完全缓解(CR)或部分血液学缓解(CRh)的患者比例为30.4% (95% CI,22.5%-39.3%),其中CR为21.6%,CRh为8.8%。此外,这些患者的中位缓解期为8.2个月(95% CI,5.5-12.0),完全缓解患者的中位缓解期为9.3个月(95% CI,5.6-18.3)。总体缓解率(CR + CRi/CRp + PR + MLFS)为41.6% (95% CI,32.9%-50.8%)。良好的临床试验数据将该药成功推进临床三期。
2016年12月,Agios启动了Ivosidenib治疗IDH1突变晚期胆管癌的临床三期试验,这是一项随机、双盲、平行、安慰剂对照的试验,在美国招募186名患者,试验预计在2020年8月完成。
有消息称,Agios计划将于2017年底向美国FDA提交NDA申请,用于治疗复发、难治性急性髓性白血病。
IDH1/IDH2抑制剂
Vorasidenib (AG-881)
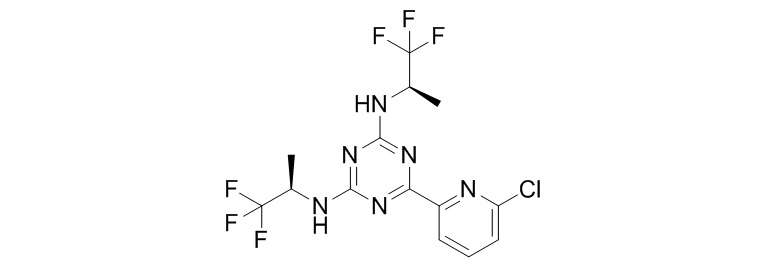
Vorasidenib也是由Celgene与Agios Pharmaceuticals共同研发的一款广谱的IDH1/IDH2抑制剂,它能同时抑制IDH1m和IDH2m。目前处于临床一期研究阶段,拟用于治疗恶性实体瘤(如胶质瘤)及恶性血液肿瘤(如急性骨髓性白血病(AML)和骨髓增生异常综合征(MDS))。
肿瘤代谢疗法是与免疫疗法并行的一个主要治疗癌症的研发方向,通过降低致癌代谢物间接抑制肿瘤生长。目前来看,异柠檬酸脱氢酶(IDH)抑制剂的临床安全性数据和有效性数据均比较乐观,有望成为抗肿瘤药物的热门靶点。
[1] Drugs@FDA
[2] 药渡数据data.pharmacodia
[3] Enasidenib: First Global Approval
[4] IDH mutations incancer and progress toward development of targeted therapeutics
[5] Agios spotlights promising data for IDH1 drug, putting it on the path to FDA submission



合作咨询
![]() 肖女士
肖女士
![]() 021-33392297
021-33392297
![]() Kelly.Xiao@imsinoexpo.com
Kelly.Xiao@imsinoexpo.com
 2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57
2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57