圣诞节前夕,百健(Biogen)和卫材(Eisai)宣布其共同开发的阿尔兹海默病(AD)药物BAN2401在一个持续12个月的II期临床试验中未达到一级终点(Biogen的阿尔茨海默病药物临床二期失败,股价下跌4%)。面对这样的结果,两家公司均表示不会放弃开发,后续将继续一个18个月的临床试验并以中枢粉状蛋白类生物标记物来替代临床终点。然而这并不能让人们对此信心满满,以生物标记物水平做指标,本身就不能保证可靠的临床药效。BAN2401是一款β淀粉蛋白抗体,这一失败再次给以β-淀粉样蛋白为靶点的抗AD药物开发蒙上了一层阴影。
人们不会忘记去年感恩节前,礼来公司的抗体药物Solanezumab的临床失败所带来的巨大影响。随着以淀粉样蛋白为靶点的多种药物不断在临床试验中折戟沉沙,基于这一假说的相关研究热情也在逐渐衰退。越来越多的制药公司将目标转向了其他的假说和机理,如神经递质,神经炎症,细胞凋亡和Tau蛋白病变等。其中Tau蛋白病变以微管相关蛋白Tau聚合物的出现为特征,是AD的标志性病变之一,特别是Tau蛋白的病理机理与认知功能减退联系更加紧密。因此Tau正受到来自世界范围内AD药物研发领域的重视,今天我们就对Tau靶点相关内容做一个系统梳理。
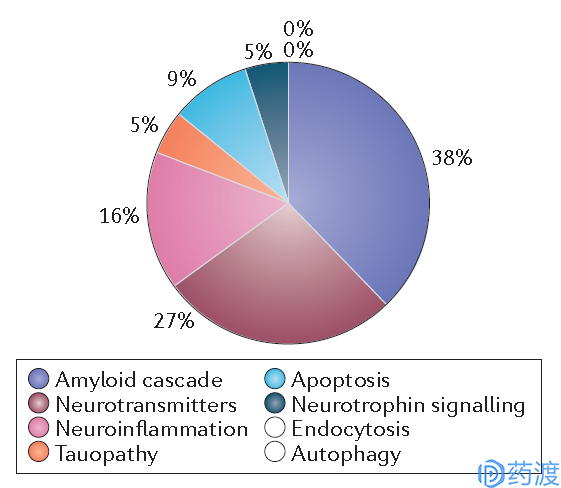
图1 正在开展的临床试验中,不同机理的投资占比(图片来源:参考文献3)
Tau蛋白的背景介绍
Tau蛋白是微管结合蛋白家族中的一种支架蛋白,在正常的神经元中,Tau蛋白主要富集于神经元轴突周围,主要功能包括调节、维持微管稳定性、辅助神经元轴突的运输功能等。Tau蛋白共包含四个功能区域,分别是:氨基端投射功能区(Projection domain)、脯氨酸富集区、微管结合区(MBD)和碳端功能区(图2)。在溶液中,Tau蛋白通常处于非折叠状态,带有交替排列的负电荷氨基酸(谷氨酸、天冬氨酸、磷酸化丝氨酸、苏氨酸和酪氨酸)和正电荷氨基酸(精氨酸和赖氨酸)。通过MBD结合微管能够引起Tau蛋白的结构改变,使得负电荷区域从微管表面产生分支,形成一个链接基团(linker)与如膜联蛋白等膜组分连接在一起。脯氨酸富集区的序列包括PxxP基序。较短的碳端功能区似乎可以抑制Tau蛋白聚合,这段区域的缺失可能与Tau蛋白在AD中的丝状结构形成有关。
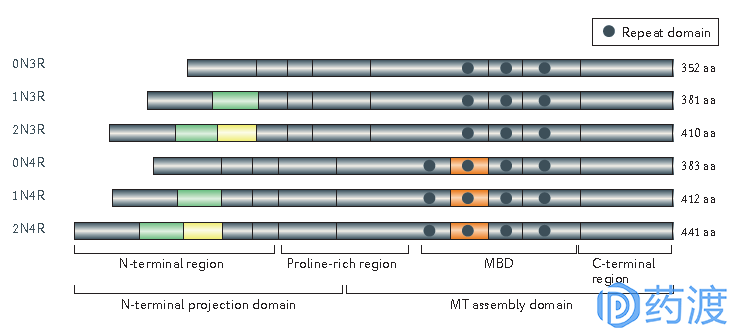
图2 人类中枢神经系统六种Tau蛋白亚型序列及四大功能区分布(图片来源:参考文献2)
Tau蛋白的病理生理学
研究发现Tau蛋白的翻译后修饰(post-translational modifications, PTMs)是调控其蛋白结构和功能的重要方式。其PTM的形式有很多,包括像糖基化、乙酰化、截断等,但是最主要的一种方式就是磷酸化。正常生理条件下,这些修饰也是广泛存在的,只是在病理环境中他们会变得更加剧烈。Tau蛋白中的脯氨酸和赖氨酸残基含量非常高,并且有超过80个潜在的磷酸化位点,这么多的脯氨酸和赖氨酸个数,使得Tau在病理状态下由过度磷酸化导致的相互交联,和通过缩合反应与其他Tau分子的聚集,变得更加容易。在病理条件下,Tau的磷酸化水平是正常的2-3倍,这种过磷酸化使得Tau蛋白从微管上脱落下来,胞质中的Tau含量上升,发生聚集形成难溶的纤维束,最终导致神经纤维纠缠,这也是AD的一个重要的病理特征。Tau在正常生理条件下存在广泛的翻译后修饰,但是在病理条件下,翻译后修饰会更加的猛烈,导致tau聚集并限制其清除。虽然上述过程的具体机理尚不清楚,但基于不同Tau病变的观察,我们能够确定的是,这一过程是受到来自多方面的调节。Tau蛋白的体内平衡可以被多种方式干扰产生一系列的生化反应,从而导致不同大脑区域、不同细胞类型发生相应变化,表现出不同的临床症状,所以这些PTM位点将是潜在的治疗靶点。很多病理状态下的磷酸化位点,在AD患者的脑组织中都得到了确认,基于此机理科学家开发了很多特异性抗体。与磷酸化相关的激酶包括GSK3-β,CDK5,CDK2等。
Tau蛋白病的分类和动物模型
Tau蛋白病包括一系列的神经退行性疾病,如额颞叶痴呆(bvFTD)、迟滞型失语症(PNFA)、词义性痴呆(SD)等。虽然有这么多的种类,但是考虑到这些Tau蛋白病的共性都是过磷酸化,聚集形成纤维化聚合物,我们有理由去假设至少一部分相关靶向的药物都将是广谱药物。
在Tau蛋白研究中使用的绝大多数动物模型为转基因小鼠,通过特定的神经元启动子来表达野生型或突变型Tau蛋白。除了小鼠,其他动物,包括其他啮齿类动物都很少用于Tau蛋白研究。究其原因,一是这些模型与小鼠和人体组织的内在差异;二是试验动物的周龄/年龄选择。老年动物有助于将研究结果从动物模型向人的转换,但如果选择老年大动物来建立模型则需要考虑培育的成本,还有随年龄增长而带来的共患病的影响。
Tau蛋白的致病机理
一个广泛的共识是Tau蛋白在疾病的发展中部分转变为**亚型,针对Tau蛋白病变的药物就是基于此——Tau蛋白**而开发的。这一过程很可能就是由一系列的翻译后修饰,比如磷酸化的帮助下完成的。另外,Tau蛋白通过折叠而成的一个介于二聚体和纤丝之间的寡聚体(Oligomer)也能够使其产生**(图3),这些PTM之间的关系现在尚不清楚。
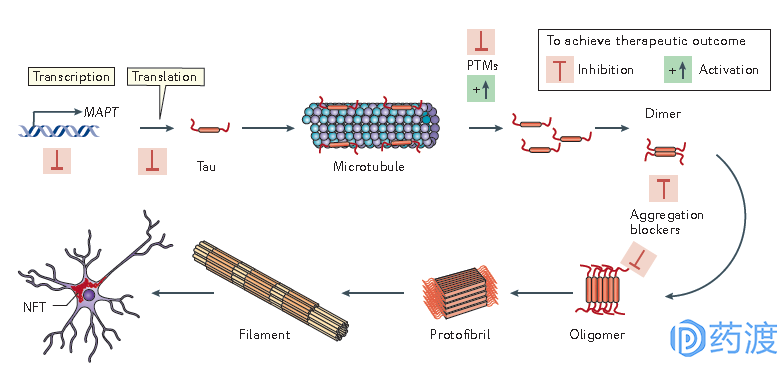
图3 Tau蛋白的致病机理(图片来源:参考文献2)
目前对于Tau蛋白病变的发病机理存在几种假说。在AD领域,淀粉样蛋白假说作为上游与Tau蛋白变性理论结合到了一起。在病理状态下,突触后Tau的正常组装蛋白功能被显著提升,最终在Aβ信号介导下产生下游**,比如钙离子内流。另一种假说是Tau蛋白聚集阻止了细胞的清除机制,这种早期的动态聚集最终促进了纤维的形成和生长。针对这一过程的药物包括各种Tau聚合抑制剂,如亚甲蓝等。第三种假说是Tau病变损害了轴突的物质输送,包括线粒体损伤等。线粒体功能受损,进而增强了氧化应激,更容易发生磷酸化,使得线粒体自噬系统紊乱。
另一个问题就是在AD早期阶段通常只有一部分大脑区域受到影响,但是在疾病后期阶段往往扩散至整个大脑区域。这又是什么原因造成的呢?答案就是Tau蛋白的扩散。研究发现,AD患者脑中的Tau蛋白可以通过扩散最终导致脑中各个区域发生变性(图4),通过向转基因小鼠海马,及皮层神经元中注射死亡AD患者的脑提取物,再对临近脑组织进行分析是否发生了Tau病变。研究人员发现扩散的速度首先取决于两处组织信号介导的连接紧密性,而不是物理距离,这是由于Tau蛋白是先被神经元释放到胞外,再被其他的神经元摄取,从而完成扩散的,当神经元更加活跃时,Tau蛋白扩散也会加剧。值得注意的是,将注射入脑后产生的内生Tau蛋白移除,虽然不能阻止其扩散,但是结果显示这样的确能够降低蛋白**。这说明针对胞外Tau蛋白进行治疗,可能会比针对神经元内的蛋白更容易,也更有效。
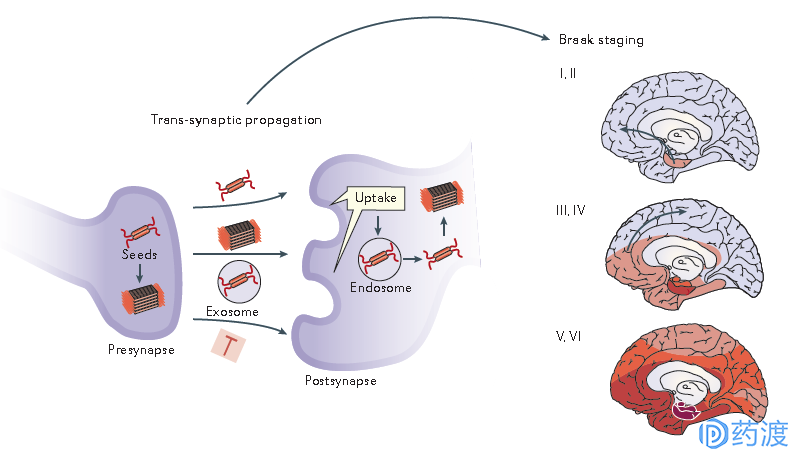
图4 Tau蛋白的扩散(图片来源:参考文献2)
以Tau蛋白为靶点的药物治疗策略及产品管线
目前正在进行临床试验的以Tau蛋白为靶点的候选药物,主要是通过减低Tau蛋白水平,阻止其聚合或针对其翻译后修饰的调控。直接靶向的药物包括聚合抑制剂和**。间接靶向的药物主要指PTM调节剂,包括微管稳定剂和激酶、磷酸调控剂。其它还有降低Tau蛋白寡聚化、促进自噬和蛋白质清除、增强线粒体功能和减轻氧化应激等。下面结合作用机制对典型的在研药物做简要介绍,其余药物信息见表1。
Tau蛋白聚合阻断剂
TRx0237 (Rember),小分子药物,TauRx Therapeutics公司
Rember也被称为亚甲蓝,是一个三环吩噻嗪结构化合物。在FDA成立之前就在非洲被广泛用于治疗疟疾、高铁血红蛋白血症以及其他病症,是一个不折不扣的老药。1996年有研究发现该化合物能够阻断tau蛋白间相互作用,从那以后,很多研究都表明它有治疗神经退行性疾病的活性。Rember仅仅是第一代化合物,在其II期临床中出现了腹泻、眩晕等一系列不良反应终止了开发。通过构效改造得到了用于治疗AD和额颞叶痴呆的第二代抑制剂TRx0237,其结构更加稳定,能够改善药物吸收、生物利用度和耐受性。不管是TRx0237还是Rember,其背后的机理都是,通过抑制Tau蛋白聚集,或者溶解已形成的异常Tau蛋白聚集体,来影响下游如AD和其他神经退行性疾病的蛋白异常。目前该药物已进入Ⅲ期临床试验阶段,在三个相关研究中,第一个针对轻度AD患者,200mg/天的试验数据还没有公开;第二个针对轻至中度AD患者的临床试验在2016年的AAIC会议上公布了阴性结果;第三个以额颞叶痴呆为适应证的临床试验在2016年的慕尼黑ICFTD会议上公布了结果,该实验也没有达到有效终点,具体原因尚不明确。
抗体**
比起Aβ蛋白,Tau蛋白的结构更大。因此研发一款抗体**,选择正确的免疫位点也显得至关重要。总体而言在所有研发管线中,结合时间表和多功能两个角度看,目前**的前景是的。
AADvac-1,抗体药物,Axon Neuroscience
受tau裂解后产生的氨基端碎片启发,Axon Neuroscience公司设计开发了由氨基末端半胱氨酸化的tau蛋白组成的抗体药物AADvac-1,这是首个通过引发免疫应答对抗tau蛋白病变的**。2013年,AADvac-1展开了I期临床研究并展示了其安全性,随后在2015年针对早期AD患者开展临床II期研究,预计2019年结束。
RO7105705,抗体药物,AC Immune & Genentech
RO7105705是AC Immune与罗氏集团旗下的基因泰克(Genentech)合作开发的一款Tau蛋白抗体。该药物并没有公布临床前数据,其针对胞外Tau蛋白,能够抑制导致炎症反应的小胶质细胞活化。2016年6月该药物开展了临床I期的研究,今年10月份II期临床已经开始招募轻到中度的AD患者。
C2N 8E12 (ABBV-8E12),抗体药物,AbbVie
C2N 8E12是由C2N Diagnostics开发并授权给AbbVie公司的一款人源化抗体。它能够识别胞外的病变蛋白。8E12与其他抗体的不同之处在于其不需要被神经元摄取,通过特异性结合非正常折叠的Tau蛋白清除神经纤维纠缠,改善神经功能。2015年6月开始在进行性核上性麻痹患者上开展I期临床试验,目前针对AD患者的II期临床试验正在招募病人入组。
BIIB092,抗体药物,iPierian→BMS→Biogen
BIIB092是生物技术公司iPierian从家族性AD患者衍生的多能干细胞中分离出来,开发而成的一种人源化IgG4单克隆抗体(IPN007),这一药物针对胞外Tau氨基端的片段化(eTau)中和其**。 2014年,BMS收购了iPierian,将其命名为BMS-986168,I期临床研究表明该药物临床耐受性良好。2017年,Biogen又以3亿美元预付款,最终可达5.5亿美元的价格获得了该药物的授权,2017年11月,Biogen启动了针对早期AD的II期临床研究,拟招募528名受试者,该临床研究预计于明年2月份开展,2020年结束。
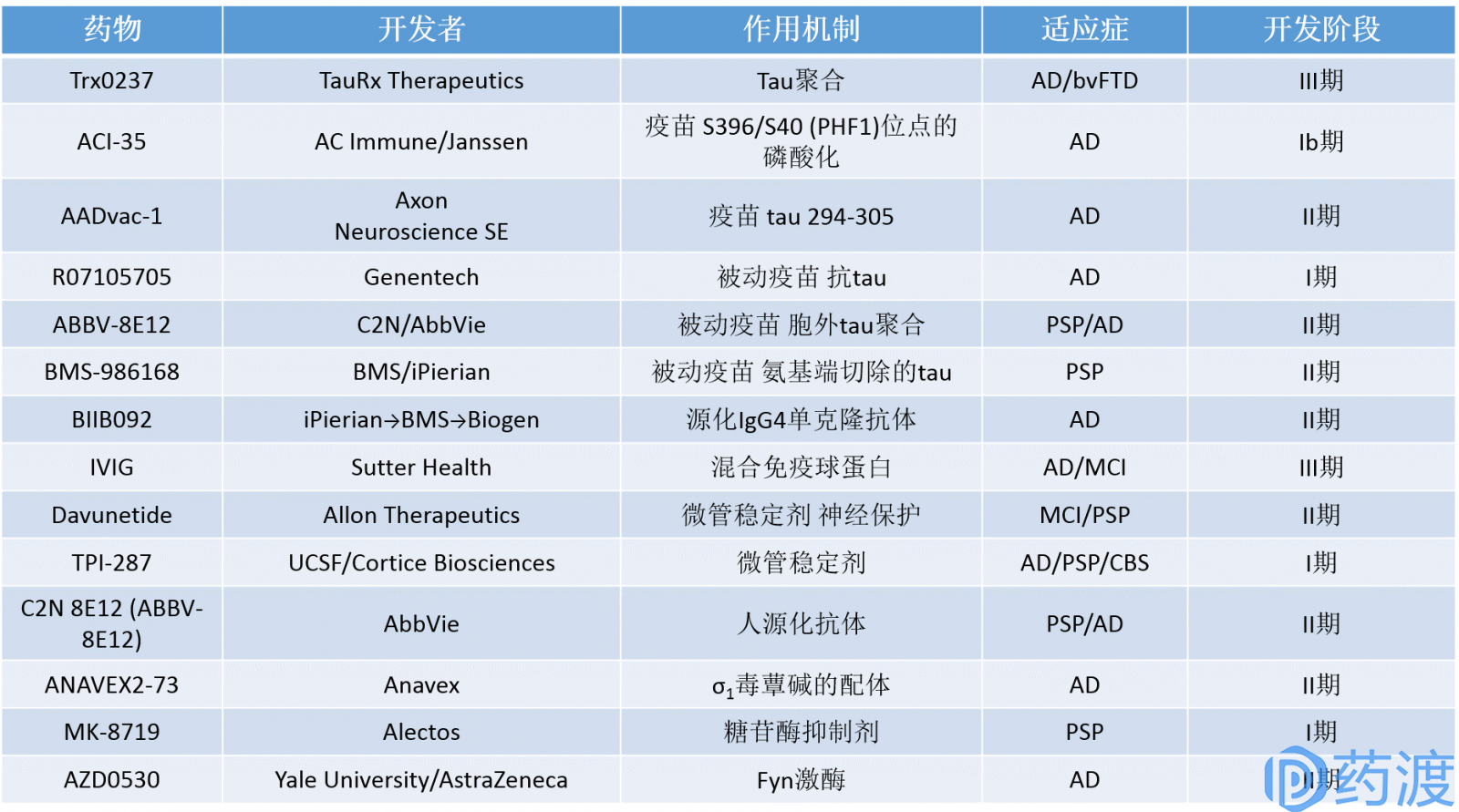
表1. Tau蛋白靶点的AD药物在研管线一览
靶向Tau蛋白PTM调控酶
由于PTM在Tau蛋白病中所发挥的关键作用,目前科学家针对参与其改变的酶而开发了一些药物。糖原合成酶激酶-3 (GSK3-β)是一个研究广泛的Tau蛋白激酶,该激酶可以使Tau蛋白过度磷酸化,在AD病理状况下会出现上调,但由于其参与很多细胞通路,因而以此为靶点的药物开发需要格外注意,激酶酶活的抑制不能超过25%。
Anavex2-73,小分子药物,Anavex公司
作为一种σ1毒蕈碱的配体,Anavex2-73能够结合毒蕈碱乙酰胆碱和σ1受体,降低GSK3-β的活性,阻止Tau过度磷酸化,改善记忆缺失,并具有神经保护作用。Anavex公司宣称一个小型IIa期临床试验结果表明该药物能够改善认知功能。
微管稳定剂
TPI287,小分子药物,Cortice Biosciences公司
TPI287是由Cortice公司(以前的Archer Biosciences)开发的一款基于微管蛋白结合和增强微管稳定的药物。作为一种紫杉烷二萜类药物的合成衍生物,TPI287与大多数紫杉烷不同之处在于它能够很好的穿越血脑屏障,进入脑中发挥药效。研究发现TPI287能够稳定微管,该药针对轻到中度AD患者为对象的I期临床试验目前正在进行中。
除了以上这些处于临床研究的药物靶点,还有一些药物将目标放在了Tau蛋白水平调节和线粒体氧化应激等方面。降低Tau蛋白含量是否会导致其他的病理状态目前还存在争议,研究表明将Tau蛋白降至一定水平还是安全的。值得关注的是,Tau相关的临床研究不仅在很多新的机理方面发展迅速,针对很多Tau病变导致的罕见病的临床研究也很多,比如PSP(进行性核上性麻痹)。这也是受到FDA政策激励而产生的景象。FDA对罕见病药物的开发给予的优惠政策包括提供7年的市场独占期和一定的资金支持,光是前者就已经让很多制药公司对孤儿药趋之若鹜。
展望未来,机遇与挑战并存
由于AD的多因子致病机理,未来的药物治疗很可能要配合个体化的精准医疗,而精准医疗的前提就是要搞清楚每个病人个体的遗传基因、神经影像,还有其特有的生物标记物水平。而以上这些特点,Tau蛋白都具备,这类蛋白的异构体形态各异,翻译后修饰具有指纹特性,这些都有利于Tau蛋白靶点药物的研发。但是也要清醒的意识到其临床研究还是面临很多挑战的。例如对疾病发展的认识还不全面;不能在AD早期之前就对其有效诊断;缺乏灵敏的生物标记物;较窄的治疗窗;如何穿透血脑屏障将药物递送到靶点等。但是这些问题也是所有AD药物研发所面临的共同问题。淀粉样蛋白和Tau蛋白两种假说就像两条平行的马路,一条路走的车太多,导航提示道路拥堵请绕行避堵,于是大家不约而同的又都来到了Tau蛋白机理。当然,导航所描述的是实况交通,而两条AD治疗理论的前路如何,尚难以下定论。路漫漫其修远兮,在失败的临床试验面前,我们绝不应悲观,AD早在100多年前就被发现,至今我们还没有完全了解它。找到治疗AD的有效方法,就像当初建造巴比伦塔一样,面对这一疾病,全人类真正成为命运共同体。而随着新成果的不断涌现,我们终将明白该病背后的精准机制,从而战胜这一可怕的疾病。
参考文献:
1.Tau蛋白的翻译后修饰与阿尔茨海默病,中国科学:化学。
2.Tau-based therapies in neurodegeneration:opportunities and challenges, Nature Reviews.
3.Tracing investment in drug development for Alzheimer disease.
4.Neuronal activity enhances tau propagation and tau pathology in vivo.
5.Alzheimer’s disease, Nature Review, 2015, 1.



合作咨询
![]() 肖女士
肖女士
![]() 021-33392297
021-33392297
![]() Kelly.Xiao@imsinoexpo.com
Kelly.Xiao@imsinoexpo.com
 2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57
2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57