PD-1单抗在国外癌症市场可谓是风声水起,同时也备受制药企业欢迎,然而在国内却是"一药难求"。相信这种情况很快就会被打破,近日有报道表示Opdivo可能成为第一个在国内上市的PD-1单抗,并且最快将会在2018年第一季度获CFDA批准。此外,国内药企也不甘落后已经纷纷开展了相关的III期临床研究,如信达生物的IBI308、百济神州的BGB-A317和恒瑞医药的SHR-1210等。
百时美施贵宝-Opdivo
Opdivo(Nivolumab)是全球首个上市的PD-1单抗,最早由日本批准,2014年获得FDA批准用于治疗黑色素瘤,到目前为此还获FDA批准用于治疗非小细胞肺癌、经典霍奇金淋巴瘤、头颈部鳞癌、肾细胞癌、膀胱癌、结直肠癌、胃癌和肝细胞癌。
由于国内严格的药物政策和审批流程,一般在国外上市多年后的新药才会在国内上市,但去年出台的一项意见中将改变这一现象。2017年10月,国务院印发了《关于深化审评审批制度改革鼓励药品医疗器械创新的意见》,这对我国医药产业创新发展具有里程碑意义,意见稿中明确进口创新药接受境外临床实验数据。这项意见的出台,将加快国内市场上新药的上市速度,改善国内癌症患者长期无药可用的困境。
就在意见出台没多久,2017年11月,百时美施贵宝向国家食品药品监督管理总局(CDE)提交了Opdivo二线治疗非小细胞肺癌的上市申请(JXSS1700015),2017年12月以"与现有治疗手段相比具有明显治疗优势"的理由纳入优先审评。Opdivo广泛的适应症、优秀的临床数据都将是其获得CFDA批准的证据,并且由于国家相关政策的改变,可以相信Opdivo获批只是将至而未至的事,有人认为2018Q1就会得到批准,拭目以待。
恒瑞医药-SHR-1210

早在2017年4月份,恒瑞医药就宣布启动PD-1抗体SHR-1210联合培美曲塞加卡铂一线治疗晚期或转移性非鳞癌非小细胞肺癌患者的开放性、随机、多中心的III期临床研究,目前的状态为进行中(招募中),已有54家医院机构、412名患者参与此研究,其主要终点为PFS,次要终点为ORR、DCR、DoR等。同月,恒瑞医药还启动了SHR-1210对照研究者选择化疗治疗晚期或转移性食管癌的随机、开放、阳性药对照、多中心III期临床研究,目前已有44家医院机构、438名患者参与此研究。
2017年12月22日,恒瑞医药宣布启动SHR-1210二线治疗晚期肝细胞癌(HCC)患者的随机双盲、安慰剂对照、多中心III期临床研究,主要终点为OS,次要终点为ORR、DoR、DCR和TTP等,目前状态为进行中(尚未招幕)。
根据药物临床试验登记与信息公示平台的数据显示,SHR-1210单一用药或组合用药开展的其他II期研究有:非小细胞肺癌、晚期肝癌、经典型霍奇金淋巴瘤、NK/T细胞淋巴瘤(鼻型),此外SHR-1210针对晚期实体瘤正在进行探索性试验。
信达生物-IBI308

2017年5月18日,信达生物在国家临床试验登记平台上公示启动PD-1单抗IBI308二线治疗晚期或转移性鳞状非小细胞肺的III期研究,目前的状态为进行中(招募中),42家医院机构参与此研究。这项随机、开放的III期研究的试验目的是评估IBI308对比多西他赛用于一线含铂化疗失败的晚期或转移性鳞状非小细胞肺癌治疗的安全性和有效性,主要终点为总生存期(OS),次要终点为无进展生存期(PFS)、客观缓解率(ORR)、疾病控制率(DCR)和持续缓解时间(DoR)。除去上面提到的III期临床研究,IBI308就其他适应症进行了II期临床研究,如食管癌、经典型霍奇金淋巴瘤和NK/T细胞淋巴瘤。
信达生物创始人,董事长兼总裁俞德超博士对IBI308 充满信心,"IBI308是信达第四个获得临床批件的药品,临床前数据显示出IBI308比目前市场上PD-1抗体药物有更显著的疗效。"
百济神州-BGB-A317

2017年10月12日,百济神州在国家临床试验登记平台上公示启动PD-1单抗BGB-A317的一项III期临床研究,与IBI308类似其患者为即往接受过含铂类药物治疗的非小细胞肺癌人群,用于二线或三线治疗,目前的状态为进行中(尚未招募),共有38家医院机构参与此研究。这项临床试验的主要目的是评估BGB-A317与多西他赛相比的安全性及有效性,主要终点为OS,次要终点为ORR、PFS和DoR等,与信达生物IBI308的III期临床试验有许多相似之处。
近日,2018年1月3日,百济神州公布启动一项比较BGB-A317和索拉非尼作为一线治疗用于不可切除肝细胞癌患者的有效性和安全性的随机开放标签多中心III期研究,主要终点为OS,次要终点为ORR、PFS和DoR等,尚未开始招募且目前只有两家医院机构参与。除此之外,生物制品BGB-A317正在进行中的临床II期研究还有:膀胱尿路上皮癌、霍奇金淋巴瘤、食管癌/胃癌或胃食管结合部癌,当然百济神州不仅进行了BGB-A317单一用药的研究,同时也研究了组合用药的效果。
百时美施贵宝PD-1单抗Opdivo的上市申请针对的是非小细胞肺癌,同样上述三家国内药企PD-1单抗最早开始的也是进行的非小细胞肺癌的III期临床试验。肺癌是世界上最常见的恶性肿瘤之一,已是我国恶性肿瘤死亡原因的第一位,而非小细胞肺癌占所有肺癌的80%。庞大的患者人群不仅为开展临床研究提供了充足的志愿者,同时也是国家与人民亟待解决的问题。
Opdivo无需在国内进行临床研究,其国外充足的临床数据已经足够,成为第一个国内上市的PD-1抗肿瘤药物马上就会实现。PD-1肿瘤免疫疗法的抗肿瘤效果是不容置疑的,比较上述恒瑞医药、信达生物和百济神州启动III期临床试验的时间,恒瑞医药极有可能会领先另外两家获得CFDA批准,但是如何设计试验以获得优秀的临床数据至关重要,真诚希望各药企尽快做出好药!
参考来源:
1. Opdivo, Repatha and Lynparza likely among China's 2018 blockbuster nods: report
2. 药物临床试验登记与信息公示平台及相关药企官网。
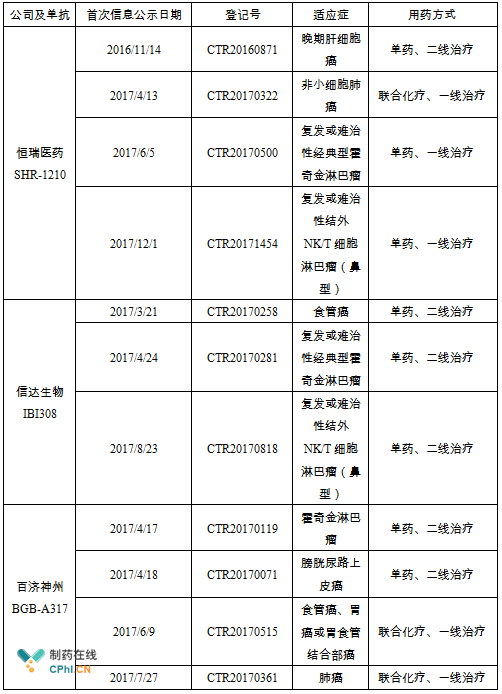
附表:IBI308、BGB-A317和SHR-1210目前开展的临床II期研究
作者简介:知行,生物化工硕士,从事细胞培养方面的研究。工作之余密切关注国内外医药行业动态以及研究进展,用简单的语言讲述不简单的未来,一个不断前行的医药人。



合作咨询
![]() 肖女士
肖女士
![]() 021-33392297
021-33392297
![]() Kelly.Xiao@imsinoexpo.com
Kelly.Xiao@imsinoexpo.com
 2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57
2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57