一、概述
1984年国会通过了《药品价格竞争和专利期修正案》(Hatch-Waxman Amendment),修订后 的《联邦食品、药品和化妆品法案》505部分为新药申请提供了三条路径:
505(b)(1):申请包含完整安全性和有效性研究报告
505(b)(2):申请包含完整安全性和有效性研究报告,但至少有部分信息来源于非申请者开展或申请者无权引用的研究。
505(j) :申请包含信息证明拟申报药物与参比制剂有着完全相同的活性成分、剂型、规格、给药途径、标签信息、质量、特性和适应症等。
505(b)(1)和505(b)(2)被称为新药申请(NDA),而505(j)则被称为简略新药申请(ANDA)。505(b)(2)申报包括新适应症、新组合、新处方、新剂型等,类似于国内化学注册新分类的改良型新药。
据汤森路透报道,改良型新药目前已经成为全球新药研发的趋势。以美国为例,从2002年到2015年FDA批准的新药类别及数量来看,在2010年前后发生了明显的变化。2010年之前,505(b)(1)占主导,2010年之后,505(b)(2)逐渐呈上升趋势,并逐渐赶超505(b)(1),2015年505(b)(2)以46:37的比例超过505(b)(1)。
二、2017年FDA批准的新剂型产品
2017年度,FDA一共批准了29个新剂型的新药申请(Type 3 - New Dosage Form)。
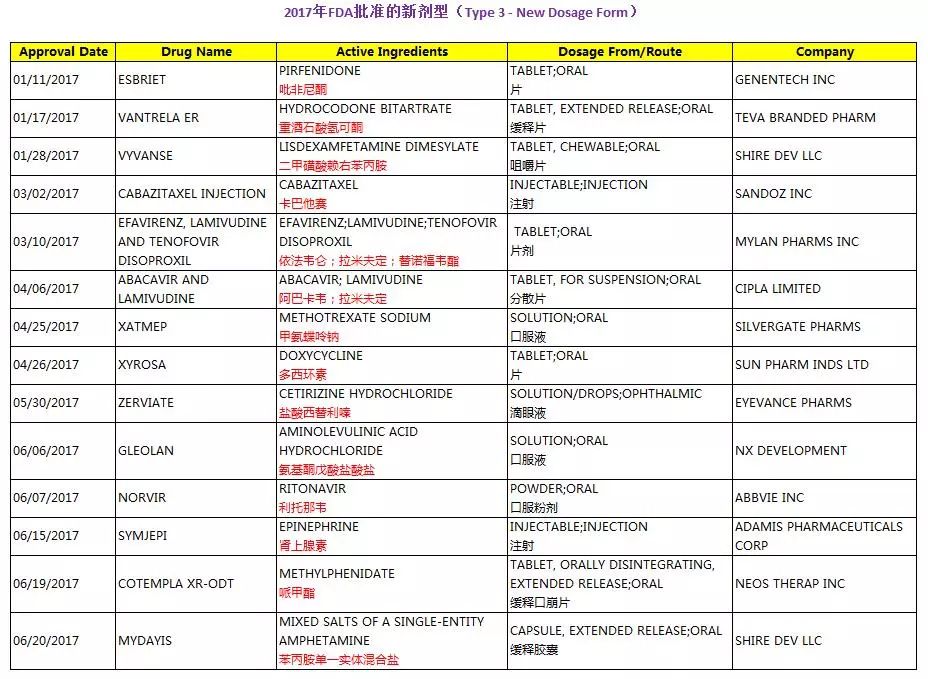
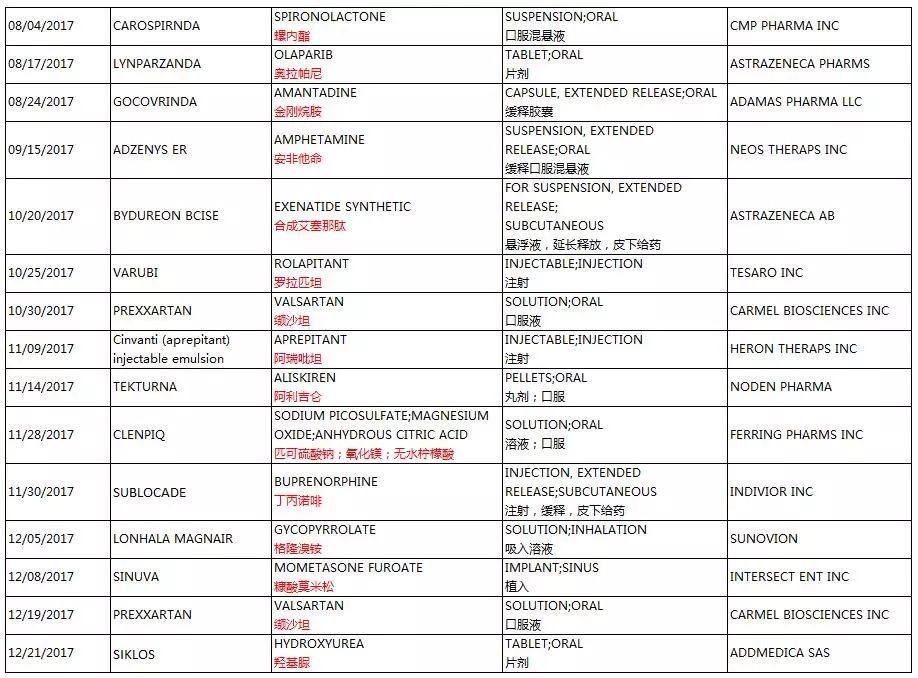
三、部分新剂型简介
1、Vantrela ER(重酒石酸二氢**酮缓释片)
Vantrela ER是由仿制药巨头梯瓦(Teva)公司开发的具有滥用威慑特性的长效阿 片类止痛药,该药采用梯瓦专利性的滥用威慑技术开发,可防止药物成分通过3种最常见的途径滥用:口服、鼻内、静脉注射。
Vantrela ER适用于疼痛严重到需要日常的、全天候的、长期的阿 片类药物治疗、以及采用其他镇痛药无法有效控制疼痛的管理,但该药不适用于仅在需要时临时服用。
梯瓦全球特种药品部门总裁兼首席执行官Rob Koremans表示,该公司深刻理解处方药滥用风险是当前医疗保健专业人员在治疗慢性疼痛方面所面对的重大挑战。尽管没有哪种技术可以完全消除滥用,但该公司开发的滥用-威慑产品仍是一个重要的进步,将为处方医师提供重要的选择,来帮助阻止或减少滥用,同时让最需要阿 片类治疗药物的患者能够获取到所需的镇痛药物。
2、Vyvanse(二甲磺酸赖右苯 丙 胺咀嚼片)
2017年1月28日,FDA批准了Shire公司的新剂型Vyvanse咀嚼片(二甲磺酸赖右苯 丙 胺咀嚼片),用于治疗注意缺陷多动障碍(ADHD)和中度至重度暴食症(BED)。
使用二甲磺酸赖右苯 丙 胺治疗,患者最常见的不良反应包括:口干,失眠,心率加快,不安,便秘及焦虑。
2007年,FDA批准二甲磺酸赖右苯 丙 胺胶囊(赖氨酸安非他命,希雷(Shire)公司)用于治疗6岁及以上儿童的注意力缺陷伴多动障碍。
2015年,FDA批准Vyvanse胶囊用于中度至重度暴食症(BED)的治疗,这是第一种获FDA批准的用于治疗此类疾病的药物。该病在美国有250万左右的患者,是该治疗领域的首药,解决了无药可治的问题。中国农村女性暴食症发病率为10万分之7,城市女性中为10万分之16.7,而在人口超过10万的大城市,这一数字为10万分之25.5,所以这个药物非常值得关注。
2016年4月14日,Shire公司宣布向FDA提交Vyvanse新替代制剂咀嚼片的新药申请,该制剂适于吞咽或打开胶囊有困难的患者。Vyvanse胶囊可整粒吞咽或打开将内容物混入水,橙汁或酸奶中服用。Vyvanse咀嚼片将为患者提供另一选择。在美国,Vyvanse胶囊适用于六岁及以上注意力缺陷/多动障碍患者和成人中至重度暴食症的治疗。
3、XATMEP(甲氨蝶呤口服液)
Silvergate Pharmaceuticals宣布,2017年4月25日美国FDA批准XATMEP(甲氨蝶呤)口服溶液上市,这是首个经FDA批准的甲氨蝶呤口服溶液。XATMEP用于治疗儿科患者的急性淋巴细胞性白血病(ALL)和多关节性青少年特发性关节炎(pJIA)。
XATMEP是一种叶酸类似物代谢抑制剂,适用于多关节性青少年特发性关节炎(pJIA)的儿科患者的活跃性疾病管理,他们对全剂量非甾体抗炎药(NSAID)的一线治疗反应不足或不耐受;也适用于治疗急性淋巴细胞白血病(ALL)的儿科患者,作为多期联合化疗维持方案的一部分。
XATMEP(甲氨蝶呤)口服溶液的开发主要是为了满足上述适应症的需要。它是一种即用型2.5 mg/mL产品,便于药品剂量的准确性和易于施用。在此之前,没有经FDA批准的甲氨蝶呤即用型口服液体制剂可供儿科患者使用。医师需要体表面积(BSA)给药,而患者展示了吞咽不便、不能服用片剂、以及针刺恐惧症等困难。XATMEP根据FDA规定在CGMP下生产。它消除了对针头注射、粉碎或分裂片剂、将片剂复合成液体制剂的进一步制备需要。
Silvergate Pharmaceuticals总裁兼首席执行官的Frank Segrave先生说:“XATMEP是一项令人激动的产品,它为儿童患者提供了FDA批准的即用型甲氨蝶呤口服液,再无需针头、粉碎片剂或混合成液体制剂。作为一家制药公司,我们继续专注于开发安全有效并且易于施用的儿科药物。”
XATMEP是一种透明的黄色至橙色口服溶液,每毫升含有2.5毫克甲氨蝶呤(相当于2.74毫克氨甲喋呤钠/毫升)。 非活性成分包括:纯化水,柠檬酸钠,柠檬酸,对羟基苯甲酸甲酯钠,对羟基苯甲酸丙酯钠和三氯蔗糖。含有氢氧化钠或盐酸pH调节剂。
4、ZERVIATE(盐酸西替利嗪滴眼液)
2017年5月30日,FDA批准了抗组胺药西替利嗪的首个局部眼部制剂(ZERVIATE,盐酸西替利嗪滴眼液),用于治疗与过敏性结膜炎相关的眼部瘙痒。
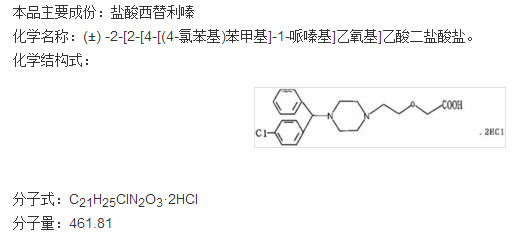
盐酸西替利嗪由强生研发,并于1995年12月8日获美国食品药品监督管理局(FDA)批准上市,商品名为Zyrtec,剂型为片剂。
ZERVIATE(盐酸西替利嗪滴眼液)由法国公司NICOX研究开发。ZERVIATE为无菌眼用制剂,规格为0.24%,每mL含西替利嗪2.40 mg(等同于2.85 mg盐酸西替利嗪),辅料组成为:苯扎氯铵0.010%(防腐剂); 甘油;磷酸氢二钠; EDTA-2Na;聚乙二醇400; 聚山梨酯80;羟丙甲纤维素;盐酸/氢氧化钠(调节pH); 和注射用水。 ZERVIATE溶液的pH值约7.0,渗透压约300mOsm / kg。包装规格:5mL/瓶;7.5mL瓶。Zerviate推荐剂量为1滴,每天2次,间隔约8小时。
5、CaroSpir(螺内酯口服悬浮液)
2017年8月4日,美国FDA最终批准了CMP Pharma公司的新药申请CaroSpir(螺内酯口服悬浮液,25mg/5mL),这是第一个也是唯一的FDA批准的利尿剂的口服液体剂型。
CaroSpir(螺内酯口服悬浮液)用于治疗NYHAIII-IV型心力衰竭并降低射血分数以增加存活率,管理水肿并减少住院治疗心力衰竭的需要,并且通常与其他疗法联合使用。CaroSpir也被用作治疗高血压的附加治疗,降低其他药物不能充分控制的成年患者的血压,并作为综合性心血管风险管理的一部分。最后,CaroSpir用于管理成年肝硬化患者的水肿,当水肿对液体和钠限制无反应时。
CMP Pharma公司首席执行官Gerald Sakowski说:“CaroSpir将为成年患者,包括吞咽困难或不能吞咽的患者提供方便、有效的液体治疗选择。到目前为止,这些患者经常接受由医院配制的螺内酯液体形式药物治疗,这个复合液体的给药不一致,长期以来一直是医生的持续挑战。”
6、Mydayis( 苯 丙 胺单一实体混合盐缓释胶囊)
2017年6月20日,FDA批准了英国制药商Shire的长效药物Mydayis( SHP465,苯 丙 胺单一实体混合盐产品),用于13岁及以上注意缺陷多动障碍(ADHD)患者的治疗。Mydayis是一种每日一次的药物,包含3种不同类型的药物缓释珠,该药不适用于12岁及以下儿童ADHD患者。Shire预计,将在今年第三季度将Mydayis推向美国市场。
Shire公司首席执行官Flemming Ornskov表示,Mydayis是该公司持续耕耘ADHD领域20年来的最新创新产品,此次批准,将为ADHD群体提供一种每日一次的治疗选择:患者每日服用一颗Mydayis胶囊,从服药后2-4小时开始见效,并且疗效持续时间能长达16小时。
7、Lynparza(奥拉帕尼片剂)
2017年8月17日,美国FDA宣布批准阿斯利康(AstraZeneca)的Lynparza(olaparib)片剂(规格100mg和150mg),用于复发性上皮卵巢癌、输卵管癌、或原发性腹膜癌成人患者的维持治疗。这些患者在先前接受铂类化疗后,正处于完全或部分缓解期。
Lynparza是一种多聚二磷酸腺苷核糖聚合酶(PARP)抑制剂,它可阻断参与修复受损DNA的酶。这款药物适用于高度预处理的与BRCA基因缺陷相关的卵巢癌。早在2014年Lynparza胶囊剂(50mg)已被FDA批准,此次批准的是新片剂剂型。
胶囊剂推荐的剂量是400毫克,每天服用两次。可见对于规格只有50mg的胶囊剂而言,患者需要每天服用16粒胶囊。如果增加胶囊剂的规格,胶囊体积将变理更大,更不利于患者的服用,或许是出于这个问题的考虑,新剂型片剂具有单位制剂的剂量更大,体积更小的优势。
“医生们在Lynparza的使用上已经有了快3年的经验。今天我们很高兴带来这一重要药物的新制剂形式,造福更广大的妇女群体,”阿斯利康全球医药开发执行副总裁兼首席医学官Sean Bohen博士说道:“今日的批准验证了Lynparza背后10多年的辛勤研究。这款全球首个PARP抑制剂能让肿瘤学家在治疗选择上有更大的灵活性。基于最近与默沙东(MSD)的合作,我们将进一步为患者带来更多治疗方案。”
8、AMANTADINE(金刚烷胺缓释胶囊)
2017年8月24日,美国FDA批准了Adamas Pharmaceuticals的新药Gocovri(amantadine,金刚烷胺,曾用名ADS-5102)缓释胶囊,用于治疗在接受左旋多巴治疗的帕金森病患者的运动障碍。这是FDA批准的首款、也是唯一一款用于此适应症的药物。
Gocovri是一款有潜力改善这一状况的药物。它含有高剂量(274 mg)的金刚烷胺,每天睡前服用一次可以提供持续一天的高水平金刚烷胺,用于治疗一天中会出现的运动障碍。
“Gocovri的获批是帕金森病治疗领域的一个重大进展,它是首个获FDA批准的用于治疗帕金森病患者的运动障碍的药物,”堪萨斯大学医学中心的神经学教授兼堪萨斯大学 医疗 系统帕金森病卓越中心主任Rajesh Pahwa博士表示:“值得注意的是,Gocovri是首款在临床试验中被证明可以同时减少在服用左旋多巴的帕金森病患者的运动障碍和‘关闭’期的药物。运动障碍和OFF时间的治疗在帕金森病医疗管理中仍是未被满足的需求,Gocovri的获批是朝这个方向迈出的重要一步。”
9、ADZENYS ER(安非他命口服悬浮液)
2017年9月15日,FDA批准了 NEOS THERAPS INC公司的新药ADZENYS ER(安非他命口服悬浮液)上市,这是一种新剂型。
ADZENYS ER是一种延长释放的口服悬浮液,含有大约相等量的立即释放和延迟释放的安非他命。ADZENYS ER用于治疗6周岁以下注意力缺陷多动障碍(ADHD)患者。
ADZENYS ER还含有以下非活性成分:纯水,山梨醇,丙二醇,黄原胶,天然橙香料,甲基丙烯酸和甲基丙烯酸甲酯共聚物,聚苯乙烯磺酸钠,植物油,柠檬酸三乙酯,对羟基苯甲酸甲酯,柠檬酸,三氯蔗糖,对羟基苯甲酸丙酯, 橙色(FD&C Yellow No.6)和聚乙二醇。
ADZENYS ER的浓度为每毫升含安非他命1.25毫克,为浅橙色供应至金黄色,粘稠,不透明的悬浮液,瓶装,450毫升/瓶装。
Neos Therapeutics(NEOS THERAPS INC)公司专注于开发延长释放药物递送技术平台(如下图)和创新的延长释放产品。 其现有技术能够开发延长释放药物的ODT或延长药物释放的口服悬浮液配方。

10、Bydureon BCise(艾塞那肽缓释注射剂)
2017 年 10 月 23 日,阿斯利康已经宣布美国食品和药物管理局 (FDA) 批准了 Bydureon BCise(延长释放) 注射剂,这是新剂型 Bydureon 的改进剂型,为每周一次,单次剂量自动注射,用于 2 型糖尿病成人患者使用一个或多个口服药物且控制饮食和锻炼后仍无法控制血糖,帮助其改善血糖控制。

与其他类胰高血糖素多肽 - 1(glp - 1) 受体激动剂不同的是,Bydureon BCise 有一个独特的、持续释放的微球传递系统,能够持续提供有效成分,帮助患者达到并保持稳定状态。这个创新剂型的 Bydureon BCise 装置被证明可以降低血糖水平,同时对减肥有帮助。
11、VARUBI(罗拉匹坦注射剂)
Varubi(Rolapitant)由Tesaro公司开发,是一种NK-1(神经激肽-1)受体拮抗剂,该药有两种剂型,口服剂型于2015年 9月1日获得FDA批准,联合其他止吐剂用于预防与致吐性癌症化疗(包括但不限于高度致吐性癌症化疗HEC)初次或多次治疗相关的迟发性恶心及呕吐。注射剂型于2017年10月25日获得FDA批准,规格为1.8MG/ML,新剂型上市给呕吐严重不能吞服片剂的患者提供了更好的选择。
12、PREXXARTAN(缬沙坦口服液)
2017年10月30日,CARMEL BIOSCIENCES公司的PREXXARTAN(缬沙坦口服液,规格为4mg/ml)已获得美国食品和药物管理局(“FDA”)的暂时批准;在2017年12月19日转为了最终批准。
2017年10月31日,Medicure Inc.制药公司宣布,通过其子公司Medicure International Inc 已经获得在美国及其领土内销售和销售PREXXARTAN?(缬沙坦)口服溶液的独家许可——获得卡梅尔生物科学有限公司(“卡梅尔”)七年的授权,并可延长期限。Medicure预估于2018年第一季度正式推出PREXXARTAN。
Medicure已预付款了10万美元的许可权费用,并在FDA的最终批准后支付额外的40万美元。 卡梅尔公司还将从PREXXARTAN?的净收入中收取版税和里程碑费用。
13、Cinvanti (aprepitant) injectable emulsion(阿瑞吡坦注射乳剂)
2017年11月10日,位于美国圣地亚哥的Heron Therapeutics公司宣布:美国FDA批准了其新药CINVANTI(aprepitant)注射式乳剂上市,在接受高度致吐性癌症化疗的患者中预防和治疗相关的恶心和呕吐。癌症患者往往因为难以承受化疗的副作用而放弃治疗,或影响治疗效果,此款抗呕吐药的获批,真真是为正在或准备化疗的癌症患者带来福音,癌症患者再也不用抱着盆痛苦的呕吐。
CINVANTI是一款底物P/神经激肽-1受体拮抗剂,也是唯一一款用于该适应症的无聚山梨醇酯80静脉注射型配方。在两项关键的随机、交叉的生物等效性试验中,研究人员确定了CINVANTI的疗效。
14、TEKTURNA(阿利吉仑口服丸剂)
2017年11月24日,FDA批准了NODEN PHAR MA公司的TEKTURNA(阿利吉仑口服丸剂)上市。
阿利吉仑为第二代肾素抑制剂,是新一代非肽类肾素阻滞药,能在第一环节阻断RAS系统,降低肾素活性,减少AngII和醛固酮的生成,不影响缓激肽和前列腺素的代谢,起到降血压和治疗心血管疾病的作用。其片剂剂型已经于2007年被批准。
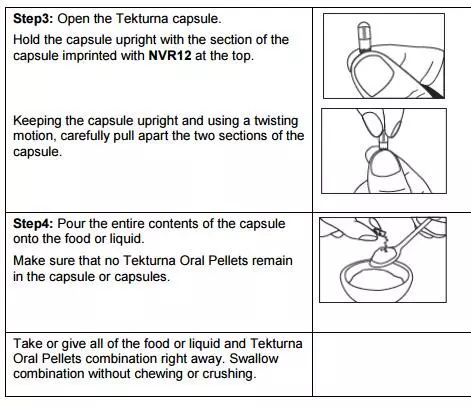
这次批准的是阿利吉仑人新剂型口服丸剂, 每个药丸含有3.125mg阿利吉仑,相当于3.45mg阿利吉仑半富马酸盐,每37.5mg口服药丸的剂量相当于41.44mg阿利吉仑半富马酸盐。37.5mg药丸被装在一个羟丙甲纤维素胶囊壳中,羟丙甲纤维素胶囊壳不参与给药,只作为容器,服用时把药丸倒出,且不可以嚼碎药丸。
15、Sublocade(丁 丙 诺 啡 缓释注射液)
2017年11月30日,(FDA)已经授予了Indivior公司旗下Suboxone每月注射版本的销售权利,这无疑为该公司在阿 片成瘾市场上的表现有很大的帮助。
这种药物将以商品名Sublocade(RBP-6000)销售,是一种每月注射的丁 丙 诺 啡 ,其中含有温和的阿 片类药物,以帮助吸毒者逐渐戒除阿 片类药物。该药物旨在作为治疗计划(包括咨询和社会心理支持)的一部分。
美国FDA局长Scott Gottlieb医学博士表示:“每个寻求阿 片类药物障碍治疗的人都应该有机会获得最适合临床需求的治疗方法,并结合咨询和社会心理支持,作为综合康复计划的一部分。作为我们正在进行的支持阿 片类药物成瘾患者治疗工作的一部分。FDA计划发布相关指导意见,以加速开发新的阿 片药物成瘾治疗方案。我们将继续努力推动和批准更广泛使用的、安全有效的疗法来治疗成瘾症状。”
16、LONHALA MAGNAIR(格隆溴铵吸入溶液)
2017年12月5日,美国食品药品监督管理局(FDA)已经批准格隆溴铵吸入溶液(25微克,两次/天)(Lonhala Magnair,Sunovion Pharmaceuticals),也称SUN-101 /eFlow?,用于维持治疗慢性阻塞性肺病(COPD)成人气流阻塞,包括慢性支气管炎和/或肺气肿。
Lonhala Magnair 是FDA批准用于治疗COPD的第一种雾化长效毒蕈碱拮抗剂(LAMA)。 Sunovion在新闻稿中表示,这是PARI Pharma GmbH开发的Magnair eFlow技术系统被首次使用。

该公司表示:“这项技术是一种几乎无声的,便携式的封闭系统雾化器,设计用于在两到三分钟内递送药物,并允许人们在使用该设备时正常呼吸。



合作咨询
![]() 肖女士
肖女士
![]() 021-33392297
021-33392297
![]() Kelly.Xiao@imsinoexpo.com
Kelly.Xiao@imsinoexpo.com
 2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57
2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57