江苏恒瑞医药股份有限公司及子公司上海恒瑞医药有限公司近日收到国家食品药品监督管理总局核准签发的《审批意见通知件》。另,恒瑞医药、上海恒瑞收到国家食药监总局核准签发的《药物临床实验批件》,并将于近期开展I期临床试验。
药品名称:SHR9549
剂型:原料药
申请事项:国产药品注册
注册分类:化学药品
申请人:江苏恒瑞医药股份有限公司、上海恒瑞医药有限公司
受理号:CXHL1700177
批件号:2017L05260
审批意见:根据《中华人民共和国药品管理法》及有关规定,经审查,本品符合药品注册的有关要求,批准本品制剂进行临床试验。
药品名称:SHR9549片
剂型:片剂
申请事项:国产药品注册
注册分类:化学药品第1类
申报阶段:临床
申请人:江苏恒瑞医药股份有限公司、上海恒瑞医药有限公司
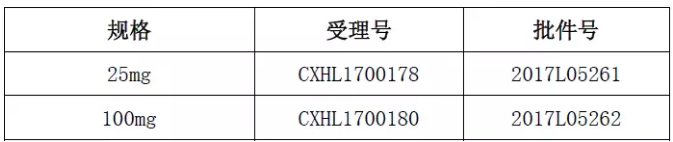
审批结论:根据《中华人民共和国药品管理法》及有关规定,经审查,本品符合药品注册的有关要求,批准本品进行临床试验。
2017年6月29日,恒瑞医药和上海恒瑞向江苏省食品药品监督管理局递交的药品注册申请获受理。SHR9549是一种口服小分子选择性雌激素受体下调剂,拟适用于ER阳性与HER2阴性的乳腺癌。
第一代选择性雌激素受体下调剂氟维司群由阿斯利康公司开发,于2002年获得美国食品药品监督管理局的批准,用于治疗雌激素辅助治疗后复发的ER阳性的乳腺癌以及与CDK4/6抑制剂palbociclib联合,治疗经雌激素治疗后发生转移的ER阳性与HER2阴性乳腺癌。该产品于2010年6月在中国获批进口。
经查询,目前国内有正大天晴药业集团股份有限公司提交了氟维司群注射液申报生产的注册申请,以及印度瑞迪博士实验室有限公司提交了该产品进口申报临床的注册申请。2016年氟维司群中国销售额约为543.5万美元,全球销售额约为7.9亿美元。
截至目前,公司在SHR9549及片研发项目上已投入研发费用约为2340万元人民币。



合作咨询
![]() 肖女士
肖女士
![]() 021-33392297
021-33392297
![]() Kelly.Xiao@imsinoexpo.com
Kelly.Xiao@imsinoexpo.com
 2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57
2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57