昨晚, 关于信达生物PD-1抗体风云又起,一篇题为《创新药炒作遭遇棒喝,信达单抗被劝退》在朋友圈转了一圈。但是多位圈内人士均对此文保持谨慎态度,多评价为标题党、内容不实。如今微信圈各种文章横飞,还是先让子 弹飞一会,静待剧情反转。
虽然关于信达的PD-1单抗——信迪单抗撤申请传闻已久,但是一直也未见到正式官方声明。虽然中间争议颇多,但是信迪单抗的申请也促使了CFDA紧急发布了两个指导文件,而这两个文件,为新药申请带来的积极影响也是显而易见的。作为抗体药物领域的标杆企业,信迪单抗药物本身应该不会有太大问题,即使是通过申请孤儿药扩大适应症也没问题,可能存在问题的地方应该在申报流程问题。
信迪单抗最终依据《临床急需药品有条件批准上市的技术指南(征求意见稿)》,满足““临床急需药品有条件批准上市是指对用于治疗严重危及生命且尚无有效治疗手段的疾病的创新药”的要求”并使用“替代终点指标或中间临床终点指标的临床研究结果可以预测该产品很可能具有疗效和临床获益而给予有条件批准上市” ,完成上市。这种策略必然也会在短期成为其他药物争相模仿的策略,
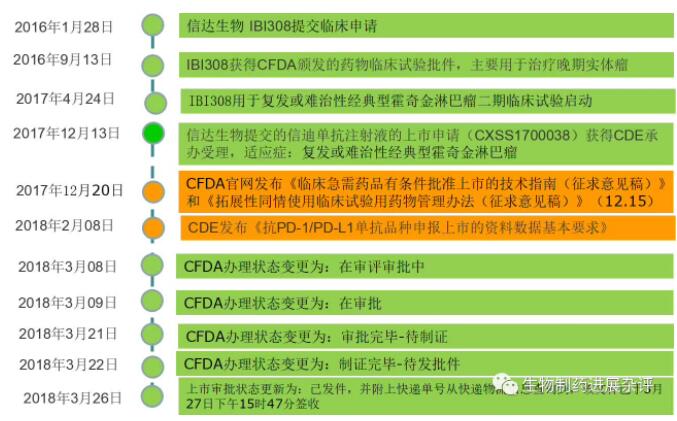
昨日梳理了一下信迪单抗的上市申报历程如下图。羡慕嫉妒恨了一下信达的速度!



合作咨询
![]() 肖女士
肖女士
![]() 021-33392297
021-33392297
![]() Kelly.Xiao@imsinoexpo.com
Kelly.Xiao@imsinoexpo.com
 2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57
2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57