人工智能和生物制药正进入它们各自的黄金时代,大量的新技术和新概念也在制药行业中被提到,但药物化学家与有机合成设计小分子技术不再被人所需要了么?人工智能如AlphaGo一般在棋类游戏中一样,在有机合成邻域彻底打倒了人类?
在DeepTech深科技等公众号疯狂宣传下,笔者试图用问答的形式,尽量细述药研行业目前所需的技术发展趋势,以及众多公众号报道中对3月自然期刊上《Planning chemical syntheses with deep neural networks and symbolic AI 》这篇文章偏面引用的情况。
2018年3月制药界大牛联名发文题目为《Organic synthesis provides opportunities to transform drug discover》的文章。
联名发文者是:
辉瑞制药的药物化学家Anthony Wood和David C Blakemore;
葛兰素史克制药公司的药物化学家Ian Churcher;
现供职于BenevolentBio公司欧洲的人工智能辅助药物研发公司;
Astex Therapeutics公司(利用"计算药物发现引擎"进行肿瘤药物开发)的药物学家David C. Rees;
罗氏制药药物化学家Andrew W. Thomas;
阿斯利康制药公司的IMED生物技术部高级总监兼肿瘤化学全球主管David Wilson;
问题1:现在我们药物研发是在如何进行工作的呢?
David Wilson:"如下图所示
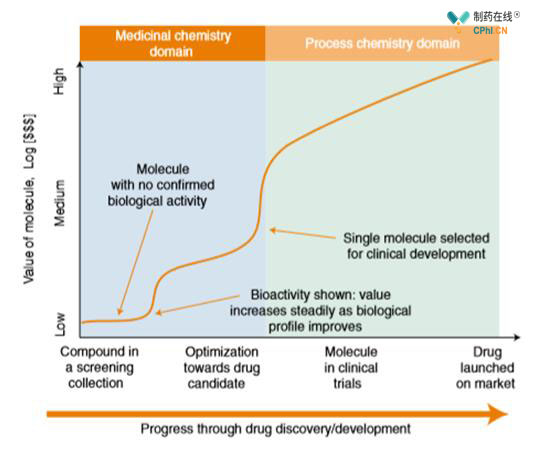
制药界投资合成一个或者一系列分子结构一般从生物学假说的相关性开始,起初的药物分子结构价值是处于的,在这个阶段我们通过大量的合成筛选分子库来去除没有生物活性的结构(第一个箭头曲线段),将有活性的分子结构进行官能团优化活性(第二个箭头曲线),当这个阶段结束后我们可以找到1个或几个活性的分子进入临床阶段(第三个箭头曲线)如果临床有效它最终将成为药物在市场上销售。
问题2:在生物大分子药占领市场的时代,有机化学或小分子化学在未来是不被需要的学科么?
Anthony Wood:"相反我们觉得远远还不够,尽管学术界进行了几十年的开创性研究,但是有机合成方法学仍旧是药物研发项目的瓶颈,我们需要克服它们才能使得新的方法学在药物研发中广泛运用。"
我们来看一下创新方法学对药物研发的相互关系:
1. 有机合成的进度是药物研发中的限速因素
2. 行业中复杂分子是否能被合成,对创新方法学研究的持续投资是必须的
我们仍迫切需要的合成技术如下:
A. 药物分子通常含有胺基,N-杂环基团,这需要更多的合成方法来'容忍'这些结构,高收率的杂环合成以及在无保护基的情况下片段的连接,仍旧是方法学的重大难题。
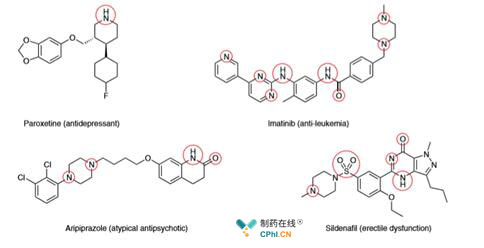
例如:红色圆圈标注的就是化合物的含氮原子部分,这些部分要么缺乏保护基保护,要么在一些反应体系中不稳定,这都需要开发更多的方法学的反应来容忍它们,使其在各类反应体系中不被干扰。
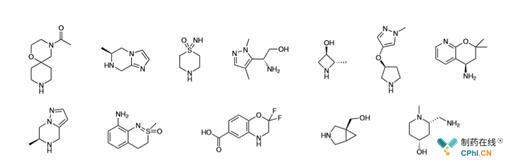
而这张图是一些已被纳入药物分子的重要分子单元结构,我们期待更多的与它们相关反应的方法学报道
B. C-H活化,杂环上的远程选择性取代,C-X和C-C键的形成,发表的新方法学需要有更广泛的底物适用性。
C-H活化以及成型药物分子上的基团修饰是重点,它的优点是可以避免我们为每个目标分子去设计一条反应路线。
杂环基团的上的基团引入是另一个重点,如何在多个相似基团上进行区域性单独激活的选择性修饰(引入甲基,氟原子或小分子基团)的方法学仍旧是新的挑战。尤其含氟取代基能非常好的调节药物的代谢和亲和性能,芳香杂环的含氟取代基反应一直非常受重视。
如:Shiozaki及其同事所描述的含氟聚糖酶的抑制剂开发中遇到的问题
如下图:
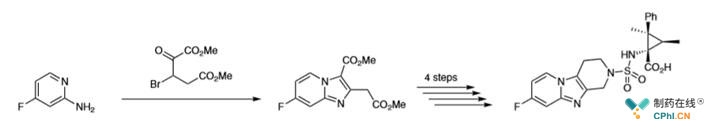
这个药物分子的F是在起始原料中引入了经过5步反应得到了最终产物
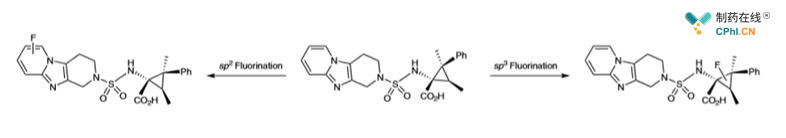
但是我们更希望看到一个更全面的方法学,使底物通过SP2和SP3机理直接在不同的位置氟化。
另一个假设的例子是:如何将-Me,-OMe,-CH2OH,-NH2,-OH,-CF3,-CHF2选择性的插入到复杂分子的目标位置。
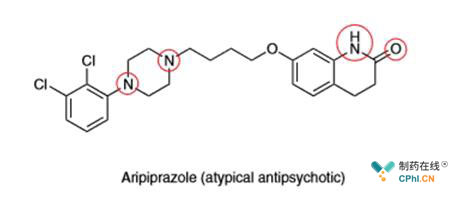
我们用上图的药物分子Aripiprazole举例,该化合物修饰最近被发表,作者通过C-H活化在二氯苯环部分引入了三氟甲基,以及使用光催化氧化反应将哌 啶 环直接氧化为二酮哌 啶 环。
C. 在药物XIAP(X连锁凋亡抑制蛋白)合成中发现的我们需要开发更多脂肪族含氮杂环的反应类型,如哌嗪,四氢呋喃,四氢吡咯等结构。
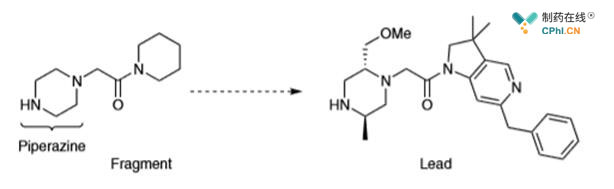
如上图:底物中哌嗪的两个-CH2-都要进行基团修饰引入甲基与亚甲基甲氧基,但是反应难度往往使得,我们选择重头合成一个含有取代基的哌嗪环,但是如果可以在哌嗪环上直接插入,这将缩短反应步骤提高合成效率。
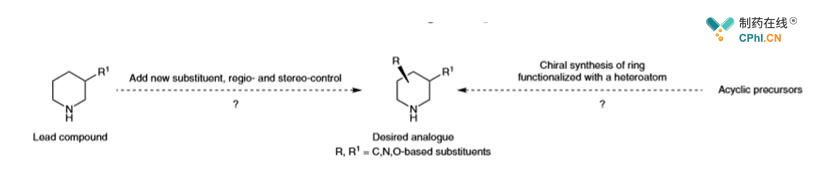
如上图:在这样的底物环上直接引入甲基或者甲氧基都是一个非常低效的合成过程,以至于这样的结构往往在药研项目最后收尾阶段才会去做,这样的进度往往影响了初期药物筛选的活性评估工作。
D. 随着小分子与蛋白质,RNA,寡糖研究领域的学科交叉,在生物大分子上做出高选择性的骨架修饰的反应方法学建立变得尤其迫切。
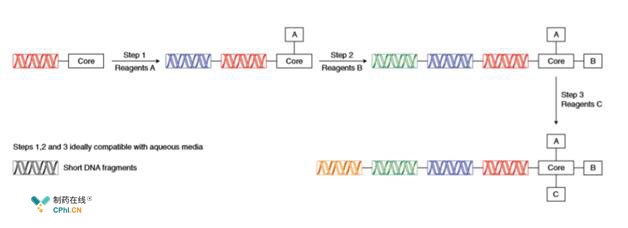
上图是个大的DNA编码库,修饰这么长链的氨基酸大分子的反应溶剂是水,而且DNA在酸性条件下稳定性非常差,这就需要我们开发出以水为溶剂的合成方法学。从药物研发角度来看小分子参与的生物大分子的修饰非常关键,特别是在天然肽残基上的引入,连接物需要进行高特异性选择性反应。但一端是易溶于有机溶剂的药物小分子,另一端是水溶性的生物大分子,这在反应均向性与选择性上给有机合成提出了挑战,Sharpless教授的"点击化学"在这方面已经有所突破。
药物化学家在进行150左右道尔顿的生物大分子上进行小分子化合物的引入研究,通过X-RAY晶体衍射,我们发现在具有特殊C-H键位置上引入额外的非天然肽残基对生物活性的提高非常有帮助。
E. C-C键活化中催化剂成本和**问题
虽然目前C-C结构在偶联中被开发的很完美,但是Pd催化剂仍旧昂贵很多偶联需要使用碘化物不利于原子经济。
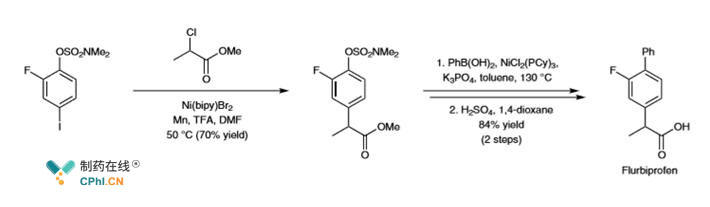
比如上图: 镇痛消炎药物氟比洛芬合成,镍催化剂显示出了廉价有效的优势,缺点是镍金属的**仍旧难以回避,如何进一步提高原子经济性和降低工艺**单杂,寻找到可替代的绿色化学方法一直是行业努力的方向。
问题3:目前产学结合的现状是?能简单介绍一下吗?
Anthony Wood:"目前制药界需要依靠学术界的创新力和人才输送,学术界既开创新的方法学又为制药界培养有机合成学科的学生。产学结合有多种形式,包括联合发表学术期刊,达成商业合作等。
近年来其中比较瞩目的机构有:
普林斯顿大学和默克公司合作的普林斯顿-默克催化中心:https://chemistry.princeton.edu/research-facilities/merck-catalysis-center
美国选择性C-H功能化研究中心:http://www.nsf-cchf.com/index.htm
牛津大学生物医学和生物综合博士生培训中心:http://www.oxfordsynthesiscdt.ox.ac.uk
制药行业非常重视分享新方法学的通用经验以及改善方法学局限性的经验交流,我们希望多国学术机构的跨学科的竞争合作变得更加平凡,最终出现全球联动的巨型项目,如:大型量子对撞机或人类基因组学计划这样的体量。
问题4:近年来迅猛发展的人工智能呢?蒙特卡洛法和神经网络正在进入药物合成领域?
有机分子逆合成设计由伟大的化学家Elias James Corey提出的,由目标分子逆推合成出更简单的片段加以拼接。但目前计算机辅助逆合成程序如Chematica等,仍旧很慢且提供的结果并不理想。
人类化学家设计特点是是优先考虑最可行的合成方法,但是那些设计反应的策略并不会全部奏效。一般原因可能是分子空间位阻或基团受到吸电子给电子效应的影响,以及设计者对反应机理不完全理解或不理解分子架构的情况。这是阻碍人类化学家最终得到目标分子化合物的障碍。
计算机辅助程序Chematica等虽然可以帮助化学家更快的找到合成路线,但是它并没有扩展到令化学家信服的水准,简单的从反应数据库中提取合成方法,已经被批评为粗放和缺乏"化学智慧"。
今年已经有不少研究小组使用蒙特卡洛树,扩展策略网络与筛选网络结合,使计算机可以预先选择最有希望成功的合成反应步骤,这些程序都是针对有机化学方法学中已发表的反应进行开发。该方法依靠学习反应合成规则和使用启发式算法,差不多比Chematica方法要快上30倍。
神经网络模仿了专家在设计路线上的直觉决策,在有希望成功的方向上进行启发式搜索。但不幸的是人工智能的分类系统必须通过成功和失败双向训练,才能明白如何从中发现高收益反应,在通过使用Reaxys数据库做模拟时,AI发现关于失败反应的报道很少,这些隐含信息的缺失是目前影响该系统进化的一个大问题。
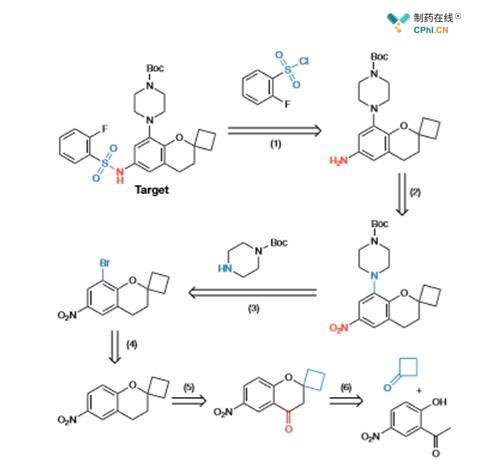
上图反应是由人工智能自己设计的,蓝色和红色标记是其'思考'后决定的反应切断点,这个过程只花费5.4秒,与最终文献报道一致,体现出人工智能设计快速高效的一面。
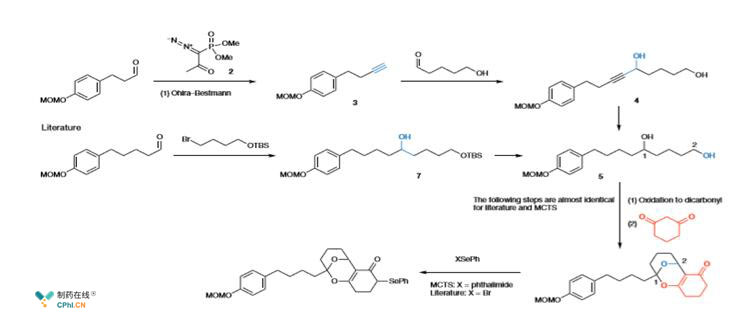
但是到了人机对抗实验时情况变得非常有趣
反应设计中人类化学家和AI为了得到化合物5使用了2条不同的合成路线以及不同的初始底物。
人工智能选择了Seyferth-Gilbert增碳反应,它使用了 不常用的Ohira-Bestmann试剂。
但人类化学家则选择了多2个碳链的底物使用格氏反应和脱保护来得到化合物5.
然后从化合物5到目标化合物,人类和人工智能的选择都保持一致。
虽然人工智能选择的合成路线也合理,但是这并非常规使用的化学合成反应,由于底物选择上的不同,以及不考虑保护基的简化反应物的内在逻辑策略,暴露出了使用AI启发式搜索思考出的合成路线的缺点。路线1在人类逆合成策略中会被批评为典型的路线设计错误,因此AI仍旧需要花费大量时间由人类专家在策略选择上持续进行训练升级。
目前人工智能遇到的3大挑战导致其难以开发出更强大的启发性算法:
1. 无法对什么是人类化学家口中的一条好的合成路线下定义
2. 人工智能希望简化合成步骤和中间化合物,所以会出现一些一锅法反应,但是AI机理避免保护基的保护与脱保护策略可能在反应设计中是有很好收益的。
3.需要解决人工智能对底物解构的选择'本能的'会向极简靠拢和催化剂的选择未能考虑有效性与易得性。
总体来说AI未来在能显著提高寻找先导化合物反应设计的有效率。人工智能将会对化合物的设计有很好的辅助,该技术在提高合成新分子的效率和降低成本方面的潜力巨大。
但目前的发展情况告诉我们一切新兴技术只是刚起步,AI完全取代人类也并非如想象中那么简单。
相关资料:Nature Chemistry volume 10, pages383-394 (2018)
Nature volume 555, pages 604-610 (29 March 2018)
Angewandte chemie.Volume55, Issue44.October 24, 2016.Pages
13650-13657
Science 26 Jan 2018:Vol. 359, Issue 6374, pp. 429-434
作者简介:陈斌,复旦药学院研究生,研究方向:天然产物活性成分的药物分析方法学建立,天然药物的质量控制研究,发表《多种生产工艺对市售门冬氨酸钾镁注射制剂质量影响的评价》。



合作咨询
![]() 肖女士
肖女士
![]() 021-33392297
021-33392297
![]() Kelly.Xiao@imsinoexpo.com
Kelly.Xiao@imsinoexpo.com
 2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57
2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57