2018年将是“一致性评价之年”。但通过的项目还不多,已通过的炙手可热!自2017年12月,CDE发布《已上市化学仿制药(注射剂)一致性评价技术要求》,注射剂的再评价工作正式启动。截至2018年4月11日,已有多项涉及多个口服和注射产品的不同品规完成一致性评价研究工作并注册申报,已批准的通过一致性评价的药品(包括注射剂)共有约20多个;已备案正在开展BE的已有1399项!4月12日的上海药交会,通过一致性评价的品种成了“抢手货”,全面竞争的发令枪已打响!特殊品种,特殊规格,特殊剂型这些“难啃的骨头”怎么做?国内特有的品种怎么办?“三改”品种如何处理?大家都很关心!
通过一致性评价的企业已切实享受到了政策红利,各地招标将通过一致性评价的药品与原研进口药品列为相同的质量层次!同时,各个地方政府还出台了一系列的鼓励、补偿、支持政策。因此,药交会上出现了通过一致性评价的产品被代理商争抢的现象!
国务院办公室和食品药品监督管理总局制定了多项通过一致性评价后的药品鼓励政策:
优先采购:同品种药品通过一致性评价的生产企业达到3家以上的,在药品集中采购等方面不再选用未通过一致性评价的品种;未超过3家的,优先采购和使用已通过一致性评价的品种医保支付:有关部门将加快按通用名制订医保药品支付标准,尽快形成有利于通过一致性评价仿制药使用的激励机制。
资金支持:通过一致性评价药品生产企业的技术改造,在符合有关条件的情况下,可以申请中央基建投资,产业基金等资金支持。
1
政策已完全明朗,发令枪已响,竞争将日趋白热
4月3日国务院又高调发文《改革完善仿制药供应保障及使用政策的意见》,重申鼓励国产仿制药质量提升的决心和信心,以落实通过一致性评价的药品的后续鼓励政策的落地,要求各地机构在采购、医保、税收、宣传等各方面给予优秀仿制药以支持,替代原研,落实处方点评制度,对有通过一致性评价产品而过度使用进口原研产品的机构进行问责!至此,业内有人曾担心或存在侥幸心理认为总局机构改革与人事变动会调整一致性评价政策,现已尘埃落定。2018将迎来国产仿制药品全面开展、评价、申报的高峰期!
2
一致性评价带来巨大的市场机会和商业价值
1、企业可以通过一致性评价,在注册申报中占得先机;
2、企业可以通过一致性评价,解决品种的历史遗留问题,例如将处方工艺与注册工艺不一致的情况彻底改变;
3、企业率先通过一致性评价,体现品种的“优质”,进而实现“优价”,重塑格局;
4、实现差异化,在竞争中脱颖而出;
5、产品可通过MAH政策变为持有人,掌握主动权,实现价值;
3
济群医药与您分享:一致性评价应该从哪里入手?
首先,针对原研药进行处方分析,利用反向工程剖析原研处方及工艺原理;测定原研制剂的多条特征溶出曲线;与原研制剂进行质量全面对比、溶出曲线对比;然后,进行制剂处方工艺的二次开发和补充申请变更注册,全面提升药品质量标准,变更处方或生产工艺,确保产品与原研制剂一致。
(一) 药学研究部分:
对一致性评价的理解不能是单纯意义上的等同评价,而应该是根据质量源于设计的原理,对药品工艺研究、生产过程、质量管理、风险控制、安全有效等多个维度的重塑。
药学一致性(CMC部分)研究,总结概括为以下(包括但不限于)十个层面的内容:
(1)对原料药质量要求:
晶型、晶癖、粒径、粒度分布、堆密度、结晶水等;
原料药供应商的审计、考察、长期稳定供应能力,并按DMF的要求和内控质量标准规范提供原料的能力。
(2)杂质及杂质谱的一致性要求:
杂质限度、未知单杂、异构体、有机残留、基因**杂质、元素杂质等均应符合ICH指南的要求;
有关物质与药品安全性有密切联系,通过研究和设计,是否可以形成差异化的竞争优势。
(3)辅料:
辅料类别、性状及质量要求,用量,用法设计;
辅料供应商辅料质量稳定性以及批间差异的要求,关键辅料提高内控质量标准;
(4)直接接触药品的包装材料的质量属性要求:
供应商的审计、考察、长期稳定供应能力;
包材相容性研究,保证制剂药效和质量一致性的基本要素之一。
(5)对工艺步骤、单元操作及关健工艺参数的要求:
目标产物或产品的关键质量属性;
针对关键质量属性的关键技术控制点和相应参数的探索和挑战,设计空间概念;
制订相应工艺规程,并进行相应验证,完成工艺耐用性研究。
(6)对生产过程的中间体的质量属性要求:
可以引起终产品质量属性的关键中间体控制指标;
(7)对制剂处方、工艺的一致性考量:
原则上应与参比制剂一致,处方组成分析——反向工程剖析原研处方的组成及具体配比;
利用现代技术手段分析原研产品生产工艺的基本原理;
控制策略:通过小、中试及生产批次的放大过程中不断试验、再认知和积累建立背景数据,并形成一整套的方法和标准,并在今后的工艺验证和生产实践中不断完善。
方法转移与验证。
(8)药品的物理性状等:
剂型、规格、重量、外观、形状、尺寸、色泽、刻痕、包装等;
硬度、崩解度、脆粹度、光洁度、包衣性状等。
(9)质量标准
含量、有关物质、溶出度、崩解时限、重金属、有机残留、水份、异构体、聚合物、无菌等;
稳定性,长期留样保持质量一致性要求、储存条件的一致性要求;
对制剂的杂质,包括原料杂质、工艺杂质、降解杂质等,关注制剂中原料药的降解产物;
生产和储存过程中是否可能会发生API转晶等问题;
关于原料药晶型,FDA并不要求与参比制剂中原料药的晶型一致,但有符合相关指南的要求;
(10)溶出曲线和体内相关的质量指标
一致性的要求并不仅仅是检验合格,一致,而是实测值的一致性对比。
不是“做出”四条溶出曲线一致即可,而是要找到真正有区分力的溶出曲线,对付出来四条曲线并不难,确保BE通过不容易!一致性是全面质量和疗效上的等同,是一次理念上的革命,需要综合技术能力的全方位提升。所以,选好评价企业,少走弯路是关键。
(二) BE研究部分:
(1)在全面数据分析的情况下,考虑体内的复杂情况:“食物效应”“”的存在、胃内容物和肠分泌物、腔内组成的变化,例如脂质和胆汁盐的存在、腔内容物(特别是食物)的消化和/或吸收,酶和菌的存在、缓冲状态、疾病因素、以及制剂因素可以以复杂的时间依赖性方式影响体内溶出。评价体内外相关性及生物不等效的风险!
(2)基于以上数据的综合分析:药物吸收部位,是否pH吸收相关,是否肠道滞留,药代动力学特点,药物代谢产物,P450酶的代谢亚型分布等综合因素。
(3)药代动力学研究的方案设计合理性与研究方案的执行力,临床监察与稽查、数据管理的科学性与规范性。
以上这些因素是影响BE研究成功与否的关键要素!选择什么样的CRO和研发机构将是您少走弯路、节约时间和降低成本的关键!
(三) 一致性评价工作的程序
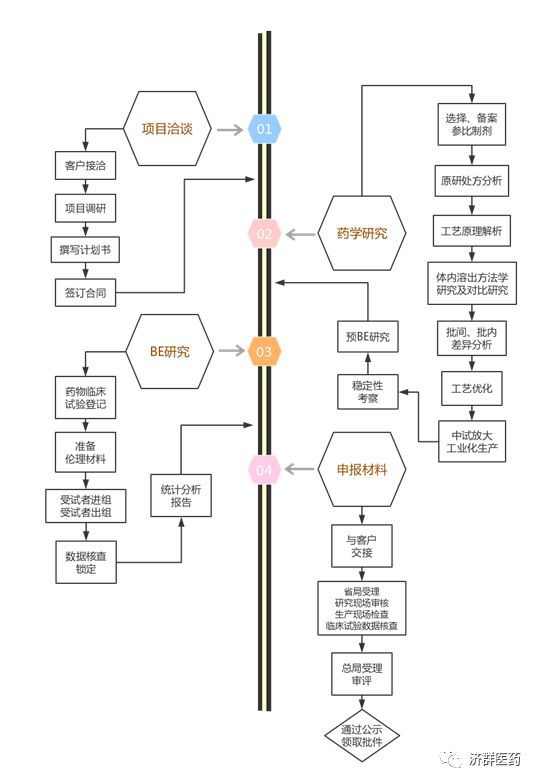
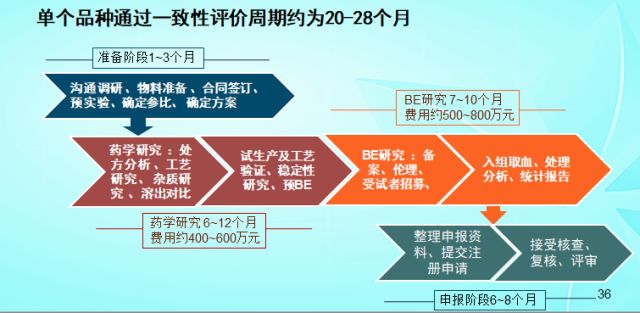
(四) 一致性评价工作的大致周期与费用:



合作咨询
![]() 肖女士
肖女士
![]() 021-33392297
021-33392297
![]() Kelly.Xiao@imsinoexpo.com
Kelly.Xiao@imsinoexpo.com
 2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57
2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57