2018年6月3日,美国47公司(Forty Seven, Inc.)公开了5F9 (抗CD47单克隆抗体)联合利妥昔单抗在复发/难治性非霍奇金淋巴瘤(r/r NHL)的临床1b/2期(NCT02953509)和5F9在实体瘤中的临床I期(NCT02216409)药代动力学(PK)和药效学(PD)部分试验结果。其中,5F9联合利妥昔单抗在弥漫性大B细胞淋巴瘤(DLBCL)中,ORR达到了40%,CR达到了33%;在滤泡性淋巴瘤(FL)中,ORR达到了71%,CR达到了43%。5F9在卵巢瘤中的临床I期药代动力学(PK)和药效学(PD)试验结果为以后联合用药提供了数据支持。详细数据将在此次美国临床肿瘤学会(ASCO)年会上进行报告。
5F9
5F9是一种针对CD47的单克隆抗体,它被设计用来干扰巨噬细胞的SIRPα受体对CD47的识别,从而阻断癌细胞发出的"不要吃我"信号,以避免被巨噬细胞吞噬。47公司最初正在开发一种名为"5F9"的研究药物,用于治疗实体肿瘤、急性髓系白血病、非霍奇金淋巴瘤和结肠直肠癌患者。目前,5F9已经获得了美国食品和药物管理局授予的复发或难治性大b细胞淋巴瘤和滤泡性淋巴瘤,两种B细胞非霍奇金淋巴瘤的快速通道认证。
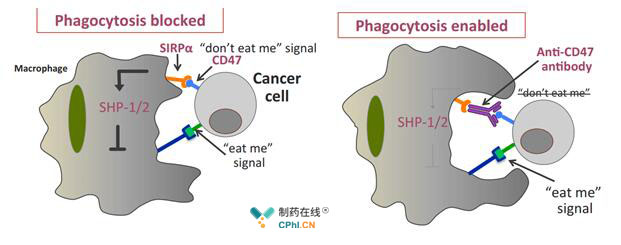
Anti-CD47 抗体作用原理[来源:https://www.creative-biolabs.com]
5F9联合利妥昔单抗在复发/难治性非霍奇金淋巴瘤临床1b/2期数据一览
临床1b/2试验的目的是对5F9联合利妥西单抗在r/r NHL患者(包括DLBCL和FL)中的安全性和耐受性剂量进行评估。这些病人在进行临床试验之前,95%患者已经对利妥昔单抗疗法产生耐药性。在试验的第1b阶段,患者接受1mg/kg的5F9作为启动剂量,以减轻病人的贫血性症状,然后是全剂量的利妥西单抗和不断增加的5F9,每周一次,从每周10mg/kg到30mg/kg。截止2018年4月,22名患者(包括15名DLBCL患者和7名FL患者)均接受了所有剂量治疗实验。
1. 安全性
截至2018年4月,所有剂量下,5F9普遍耐受良好,耐受剂量可能高于30mg/kg。大多数不良事件(AEs)为1级或2级,最常见的AEs是对红细胞的溶解作用,会导致暂时性和可逆性的贫血。据报道,其他常见的AEs报道包括寒颤、头痛、输液相关的反应和发热。只有一个病人因为AE而停止实验。
2. 临床数据
截至数据截止日期,所有剂量组的22名患者均进行了反应评估,使用PET/CT成像技术对病人的临床活性测量,其中包括对肿瘤大小和代谢活动的检测。在所有22个可评估的患者中,数据显示整体的客观反应率(ORR)为50%,完全反应率(CR)为36%。其中,5F9联合利妥昔单抗在弥漫性大B细胞淋巴瘤(DLBCL)中,ORR达到了40%,CR达到了33%;在滤泡性淋巴瘤(FL)中,ORR达到了71%,CR达到了43%。
"尽管最近取得了一些进展,但对于r/r NHL患者来说,仍然缺乏安全有效的治疗方法,特别是对于那些没有资格接受移植或新细胞疗法的患者,"参与这项研究的学者Sonali Smith表示,"这些初步数据表明,5F9可以为DLBCL和FL患者提供一种既安全又易于管理的新型治疗方案,这种方案可以迅速诱导患者受益。"
5F9单一用药在实体瘤中临床1期PK&PD数据一览
临床I期试验是为了评估5F9的安全性和耐受性,并定义推荐的剂量和时间表。试验中,总共有62名患者接受治疗。其中包括11名患者接受了PartA治疗,即接受了4次强化的启动剂量(每周1次,0.1mg/kg至3mg/kg);14例接受PartB治疗,启动剂量为1mg/kg此后3次强化治疗,(每周1次,3mg/kg至20 mg/kg);15例患者接受肿瘤活检,起始剂量为1mg/kg,维持剂量为20mg/kg;22名患者接受PartC治疗,起始剂量为1mg/kg,三次增加清华剂量(每周一次,20mg/kg至45mg/kg)。接受治疗的患者为晚期肿瘤,包括结直肠、卵巢、唾液腺、乳腺癌和其他实体肿瘤,并接受了大量的预治疗,中值为五次。
1. PK and PD
PartA中,1mg/kg被认为是最理想的启动剂量,足以饱和红细胞上的CD47,并引发补偿性网状细胞过多症,以减轻因溶解较老的RBCs而导致的贫血。PK数据显示,5F9可以在10 mg/kg或更高的剂量下克服CD47抗原吸收,基于临床前的结果,游离血浆药物水平超过预期的治疗范围。在饱和剂量水平上的PK数据显示,平均半衰期约为13天,每两周支持一次维持剂量。临床II期推荐剂量(RP2D)被定义为1mg/kg的启动剂量,然后每周服用30毫克/公斤,持续三周,然后每两周保持30毫克/公斤的维持剂量。
2. 安全性
据观察,所有剂量下,病人普遍耐受5F9,而耐受剂量没有定义为45mg/kg。调查人员报告的大多数AEs都是1级或2级。最常见的与治疗有关的AEs是CD47对红细胞的影响,包括一个可预测的和经常短暂的贫血,在CD47的启动和维持剂量治疗方案中成功地减轻了溶血现象的发生。其他经常报告的与治疗相关的AEs包括在注射部位反应、头痛、疲劳、发冷、发烧和恶心,对这些症状的严重程度和控制都是温和的。
3. 临床数据
研究中观察到了单剂5F9抗肿瘤活性的初步证据:
在卵巢癌中,有两名患者接受了确认的局部反应。这两名患者的每周维护剂量为20 mg/kg,此前至少接受了6次预治疗方案,均以失败告终。其中一名患者的持久性PR超过6个月。
从临床数据结果来看,5F9联合利妥昔单抗在临床1b/2期中表现出了良好的ORR和CR,为接下来进行的临床II期试验带来了很大希望。5F9单一用药在实体瘤中变现出了高剂量的临床安全性,单一用药未来效果还待期望,该数据也为组合疗法,如正在进行的联合免疫检查点抑制剂avelumab临床1b期提供了一定的指导。另外,针对CD47和其它肿瘤靶点的双特异性抗体(Bi-specific antibody, BsAb)相对应mAb优势更加明显,相信未来前景会更加光明。
来源:
1. http://markets.businessinsider.com
2. https://clinicaltrials.gov
作者简介:Tumour,食品科学与工程专业学士,国家三级公共营养师,生物化工专业硕士,目前为医药行业从业者,致力于癌症靶点及IRs抗体的研究开发,工作之余时刻关注医药行业动态和进展,同时从健康安全角度热切关注食品行业动态,为人类健康传播和提供科学的食品知识。



合作咨询
![]() 肖女士
肖女士
![]() 021-33392297
021-33392297
![]() Kelly.Xiao@imsinoexpo.com
Kelly.Xiao@imsinoexpo.com
 2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57
2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57