近日(6月8日),CFDA发布了《2017年度药品检查报告》,该报告对2017年度CFDA开展的药品注册生产现场检查、药品GMP跟踪检查、药品飞行检查、进口药品境外生产现场检查、药品流通检查、国际药品GMP观察检查等工作情况进行汇总、统计和分析,里面涵盖了诸多看点,笔者带大家一起来梳理一下。
图1 CFDA发布2017年度药品检查报告
看点一:检查密度增加,药品GMP跟踪检查数量骤增
表1是CFDA 2017年及2016年各类药品检查任务完成情况,相比于2016年,2017年的总检查量有很大增长,而其中主要增加的项目是药品GMP跟踪检查,单项增加了200余次;其实是进口药品境外生产现场检查,单项增加了7倍多。
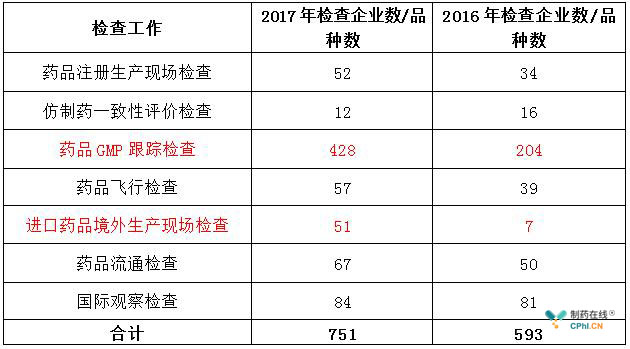
表1 2017及2016年完成各类药品检查任务一览表
看点二:药品注册生产现场检查,生物药及化学药居多
对于药品注册生产现场检查,CFDA主要依托的是《药品注册管理办法》、《药品注册现场核查管理规定》以及《关于仿制药质量和疗效一致性评价工作有关事项的公告》等法律条列。
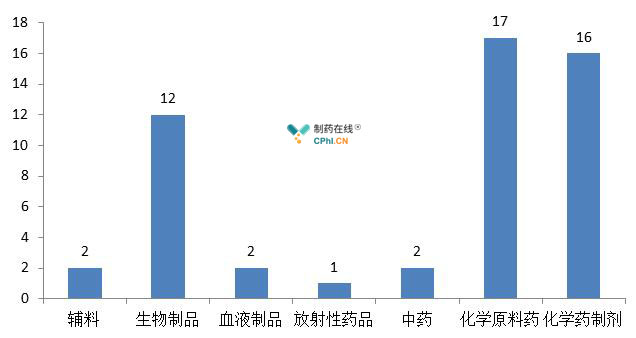
图2 2017年注册生产现场检查剂型分布图
如图二所示,2017年对于注册生产现场检查的剂型分布,生物制品、化学药制剂及原料药均居多。近年来,我国生物医药及化学靶向药物等药物开发加速,这些类别的药物检查频次增多也是在情理之中。在检查中,CFDA主要发现的问题有:(一)中试或技术转移过程中药品GMP规范执行不足;(二)偏差、超标结果调查不充分 ;(三)工艺验证不科学、不充分。
看点三:药品GMP跟踪检查主要针对高风险企业
从图3所示跟踪检查不符合企业分布情况来看,2017年CFDA对GMP跟踪检查主要针对的是高风险药企。这也正是药品GMP跟踪检查"以风险为基础,以品种为主线"的原则。
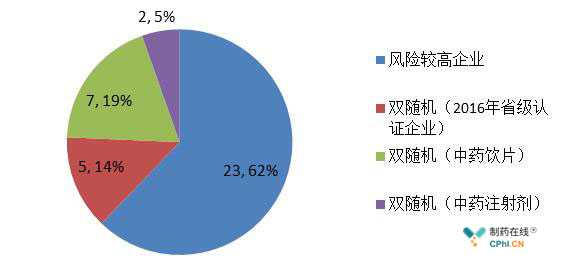
图3 2017年跟踪检查不符合企业分布情况
既然主要针对的是高风险药企,那么所检查的缺陷非常多也不足为奇了。2017年所检查的428家药品生产企业中,发现药品GMP缺陷达4339项,其中涉及药品GMP正文部分的缺陷共3512项,涉及计算机化系统附录的缺陷224项,涉及无菌药品附录的缺陷200项,涉及中药饮片的缺陷116项。
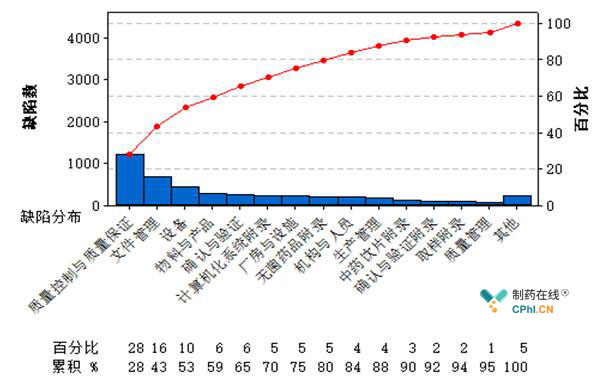
图4 药品GMP跟踪检查缺陷项目分布情况
如图4所示,质量控制与质量保证部分的缺陷在各类生产企业的检查中缺陷均排第一位,缺陷数高达1205条,占全部缺陷的28%;其次是文件管理,占比16%;再次是设备,占比10%。
看点四:中药飞检集中,问题凸显
2017年飞行检查对中药类生产企业的检查较为集中,在飞检的57家企业中,涉及中药制剂、中药饮片、中药提取物的有38家(图5)。
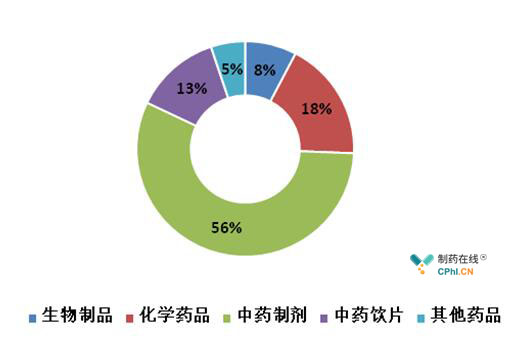
图5 药品飞行检查发现严重问题的品种分布情况
在飞检中也凸显了诸多问题,主要有:1.中成药生产企业不按处方标准投料;违背法定制法,擅自改变工艺;为应对监督检查,编造相关记录文件。2.中药饮片生产企业外购饮片直接分装、销售;未按照标准对购入或销售的中药材、中药饮片进行全检;中药提取物的生产备案。3.化学药品生产企违反注册批准工艺生产;检测原始数据无法溯源,数据可靠性存在严重问题;采用不合格原料生产药品。4生物制品生产企业过程控制数据或产品结果数据不真实;实际生产工艺与产品注册工艺不一致;使用不符合质量标准的原材料、中间体及半成品进行投料等。
看点五:进口药品境外生产现场检查频次增多,彰显我国药监执法能力提升
对比各年CFDA对进口药品境外生产现场检查任务来看,2017年CFDA的出检频次大有增加(图6),境外现场检查也彰显了我国药监执法能力提升,能够有效管控进口药品的安全性及有效性。
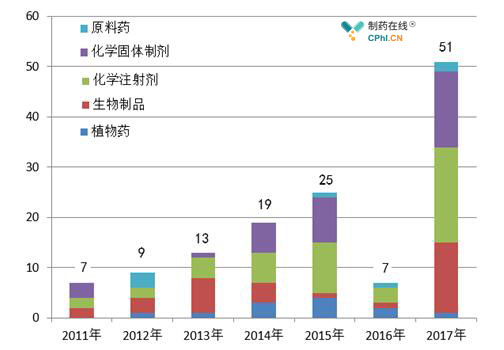
图6 2011年-2017年境外检查执行数量
据悉,对于境外检查,主要集中在欧美地区,近年对印度等国家的检查数量也在增长。检查中除了发现一些与国内药企一样的常见问题,还发现了外企生产过程中未按照中国药典执行标准的情况。
小结:
药品检查是药品安全可靠、防止假伪药品的重要手段,通过检查可以发现药品生产流通各个环节中存在的问题,从而可以有针对性地改善。同时,对严重违反相应药品生产流通条例、法律法规的药企或相应药品生产线进行取缔关停,也是在程度上保障了我国消费者的安全。但愿各大药企对《2017年度药品检查报告》中指出的问题引以为戒,为我国药物市场营造一个更为安全放心的环境。
参考:
1. http://cnda.cfda.gov.cn/WS04/CL2050/228316.html?from=singlemessage
2. http://samr.cfda.gov.cn/WS01/CL0844/173310.html
作者简介:云天,药物化学博士,主要从事小分子药物研究,尤其擅长小分子药物的合成工艺及后期药物开发研究,已完成多个抗癌药物分子的合成和活性评估。



合作咨询
![]() 肖女士
肖女士
![]() 021-33392297
021-33392297
![]() Kelly.Xiao@imsinoexpo.com
Kelly.Xiao@imsinoexpo.com
 2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57
2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57