7月9日,广西壮族自治区药监局发布《广西收回药品GMP证书公告(2018年第5号)》。
公告显示,广西世彪药业有限公司因严重违反《药品生产质量管理规范》规定,根据《药品生产监督管理办法》第五十五条及《药品生产质量管理规范认证管理办法》第三十三条规定,广西局收回该企业GMP证书,由钦州市局监督企业停止生产、并对企业存在的违法违规行为依法处理。
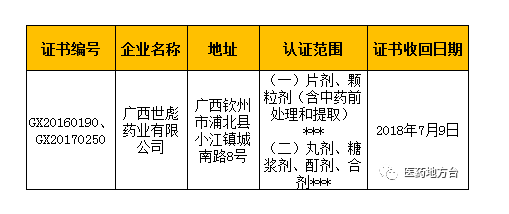
值得注意的是,此次广西世彪药业有限公司被收回的GMP证书有2张,一张认证范围为“片剂、颗粒剂(含中药前处理和提取)”、一张为“丸剂、糖浆剂、酊剂、合剂”。
广西世彪药业有限公司涉嫌违法违规行为如下:
一、片剂车间C线D级洁净区生产环境与口服固体制剂生产的要求不符,厂房、设施、设备维护不足。(一)洁净区部分地面凹陷,与墙壁圆弧角处翘起,存生锈、霉斑等现象,现场部分地漏未液封。(二)生产区内制浆间灯管锈蚀、夹层锅生锈、颗粒制造间4台摇摆式颗粒机上方2个直排罩的止回板不能正常关闭。(三)水池下方排水管无防倒灌装置,水池下部区域大面积发霉。(四)洁净区用工作服、手套、拖把均为棉质材料,易脱落纤维。
二、未对板蓝根片生产工艺进行定期再验证,未开展板蓝根稠膏储存时间验证。
三、计算机化分析仪器未建立人员登录、使用、授权、取消、变更的程序。未规定质量受权人(质量负责人)、QC室主任和操作人员权限。缺少手动积分、删除数据、修改时间的控制措施。
四、文件记录管理不符合要求。(一)该企业同时存在两份不同编号的《计算机管理制度》(编号SMP-WJ-0002-01,实施日期2014年10月1日;编号SMP-WJ-0004-01,实施日期2015年12月25)。(二)阴凉留样室现场“留样样品销毁单”、常温留样室使用的“温湿度记录表”仍使用已被废弃的版本,且缺少文件编号。(三)精密仪器室(一)现场高效液相色谱仪使用未经审核、批准的手写操作规程。(四)2016年、2017年板蓝根片产品质量回顾分析报告内容不全,缺少关键中间控制点分析、不良趋势分析等信息。(五)原料仓库中板蓝根(批号Y16-180504)标签缺少产地、品名、采收日期等信息。



合作咨询
![]() 肖女士
肖女士
![]() 021-33392297
021-33392297
![]() Kelly.Xiao@imsinoexpo.com
Kelly.Xiao@imsinoexpo.com
 2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57
2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57