近日,由国际知名医疗中心贝斯以色列执事医疗中心(BIDMC)领导的研究小组发现,三 氧 化 二 砷和视黄酸联合作用,可以有效的抗击癌症,能为不同类型的癌症带来新的治疗策略。其结果发表在8月9日国际著名期刊《Nature Communications》上,题为"Arsenic targets Pin1 and cooperates with retinoic acid to inhibit cancer-driving pathways and tumor-initiating cells"。

该研究中,在临床安全剂量的情况下,三 氧 化 二 砷(ATO)和视黄酸(ATRA)有效地抑制了许多癌症驱动通路,消除了细胞和动物模型以及三阴性乳腺癌患者衍生肿瘤模型中的癌症干细胞。ATO通过结合、抑制和降解Pin1来对抗癌症。ATRA也能结合并破坏Pin1酶,但除此之外,它增加了细胞对ATO的吸收,增加了将ATO泵入细胞的细胞膜蛋白的表达[图1]。缺乏Pin1表达的小鼠即使其细胞过度表达癌基因或缺乏抑癌基因表达,也对癌症的发生具有很强的抵抗能力。值得注意的是,这些动物在超过一半的寿命中没有显示出明显的缺陷,这表明靶向Pin1可能是安全的。而且,这种结合甚至可能在其他尚未发现的肿瘤类型中也是有效的。除此之外,这种联合延长了ATRA在人体内的半衰期,提供了一种有前途的新方法来对抗广泛的癌症,而不具有一般**作用。
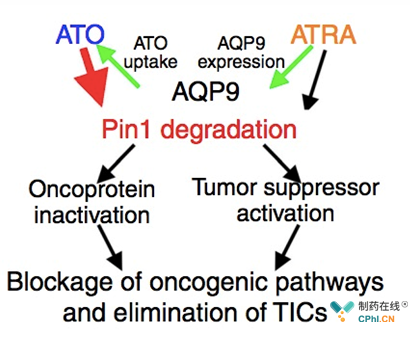
图1: A model for the cooperation of ATO and ATRA in targeting Pin1 to block multiple oncogenic pathways and eliminate cancer stem cells, two major sources of cancer drug resistance[1]
针对单一靶点阻断多种癌症驱动途径为癌症治疗提供新途径
实体瘤通常对旨在阻断单个通路的靶向治疗具有耐药性,这主要是由于同时癌细胞激活了大量的抑制通路和/或致癌基因。为了应对这一挑战,有人建议使用"基因组"技术来识别每个肿瘤中的所有激活通路,然后使用鸡尾酒疗法来抑制被识别的单个靶点或通路。然而,肿瘤内的单个癌细胞具有高度的异质性和发展趋势,许多癌症驱动因子,尤其是转录因子,是很难被药物化的。此外,目前的治疗方法并不能有效地靶向肿瘤起始细胞/癌症干细胞(TICs/CSCs),这些细胞被认为是肿瘤发生、生长、转移和耐药的重要原因。识别和抑制单个靶点来阻断驱动癌细胞和TICs中的多种信号机制,可能为克服耐药性提供一种有前途的策略。
ATO和ATRA抗癌作用早期研究
虽然公众饮用水中砷含量在一定水平上与多种癌症有决定性关联,但作为最古老的药物之一,砷一直被用于治疗从感染到癌症的各种疾病。在19世纪,砷以福勒溶液的形式作为抗白血病药物,直到20世纪早期被放疗和化疗取代。20世纪70年代,富含砷的传统中药"艾灵一号"(癌症的灵丹妙药)被发现,用于治疗急性早幼粒细胞白血病(APL)和其他癌症,用砷治疗癌症的研究再次浮出水面。三 氧 化 二 砷(ATO)被鉴定为爱灵一号的有效成分,并于1995年被FDA批准用于APL治疗。虽然公众饮用水中砷含量在一定水平上与多种癌症有决定性关联,但令人惊讶的是,其他剂量的砷含量与乳腺癌的发病率异常低有关。ATO与维生素A衍生物全反式维甲酸(ATRA)结合后,APL已从高度致命转变为高度可治愈,甚至对儿童的**也微乎其微。药物机制一直归因于两者的联合能够降解肿瘤蛋白早幼粒细胞白血病-视黄酸受体α(PML-RARα)通过作用于两个融合的合作伙伴;ATO与PML中的半胱氨酸产生共价作用,而ATRA激活RARα受体诱导细胞分化。然而,尚不完全清楚这些药物作用于哪些细胞靶点,它们如何相互作用,或者它们是否对其他类型的癌症有效。然而,它们的作用机制和功效,尤其是在其他癌症中,仍然难以捉摸。
ATO也显示出对其他血液恶性肿瘤和各种实体肿瘤包括乳腺癌和肝癌的疗效。流行病学研究表明,虽然低ATO水平的饮用水污染可能增加癌症风险,但是高ATO水平的饮用水污染明显降低了乳腺癌的总体死亡率。然而,这些抗肿瘤作用的机制尚不清楚。这个问题很重要,因为在治疗剂量的ATO中,即使在10 - 12岁的儿童中,对APL也有很好的安全性,尽管高剂量的ATO因其与细胞靶标的共价结合而臭名昭著。
类似地,常规ATRA,即使半衰期为45分钟,在临床试验中对实体肿瘤也有可检测到的疗效,但是被认为更有效的第二代和第三代靶向RARs或RXRs的ATRA类似物,在临床试验中疗效甚微。即使在APL中,ATRA激活RARs和诱导白血病细胞分化的能力可以因其活性而分开,诱导PML-RARα退化和抑制APL干细胞来治疗APL。此外,ATRA激活RARs的能力无法解释其破坏癌蛋白和稳定肿瘤抑制因子的活性。它的第二代和第三代类似物,是Pin1的抑制剂,Pin1是一种主要的常见的致癌信号网络调节因子。
Pin1在致癌信号网络中重要作用
Pin1激活了至少43个癌蛋白,使超过20个肿瘤抑制因子失活,并下调了总体microRNAs,是致癌信号网络的"主"磷酸化后调节器。此外,Pin1在乳腺TICs/CSCs中高度富集,促进其自我更新和肿瘤的发生。Pin1在病毒、细菌和寄生虫感染及其相关恶性肿瘤中也具有重要作用。因此,靶向Pin1代表了一种新的无毒策略,可以同时阻断多种癌症驱动途径,并消除TICs。然而,先前发现的Pin1抑制剂缺乏特异性、效力和/或细胞渗透性。
总之,该研究首次揭示了ATO和ATRA联合作用机制[图1]。ATO以Pin1为目标,并与ATRA合作以发挥强大的抗癌活性。ATO通过与Pin1活性位点非共价结合而抑制Pin1的致癌功能。ATRA通过上调水通道蛋白9增加细胞对ATO的吸收。ATO和ATRA在临床安全剂量下,协同消融Pin1,以阻断许多癌症驱动通路,抑制了癌细胞和肿瘤启动细胞的生长。因此,ATO和ATRA协同靶向Pin1提供了一种对抗乳腺癌和其他癌症的有新方法。
文章来源:[1] Nature Communications volume 9, Article number: 3069 (2018).
笔者简介:Tumour,生物化工专业硕士,目前致力于癌症靶点及IRs抗体的研究开发,工作之余关注医药行业动态和进展,一点笔墨,一缕拙见,一个不断前行的医药人。



合作咨询
![]() 肖女士
肖女士
![]() 021-33392297
021-33392297
![]() Kelly.Xiao@imsinoexpo.com
Kelly.Xiao@imsinoexpo.com
 2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57
2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57